羊草(Leymus chinensis )是多年生根茎禾草, 由于其营养繁殖能力很强, 且具有典型的克隆生长特性, 是我国北方典型草原的主要建群种或优势种, 在东北草原和内蒙古草原经常形成大面积的单优种植被(李永宏, 1993 )。自1980年以来, 由于长期的过度放牧, 我国北方草原生态系统的结构和功能严重退化, 羊草种群也受到了明显的影响, 其生物量和密度显著降低(王仁忠, 1997 ; 王玉辉等, 2002 )。养分添加(主要是N素添加)是恢复退化草地生态系统的一种有效手段, 但目前在草地的恢复与治理上应用较少(潘庆民等, 2005 )。因此, 研究羊草对养分添加的响应与适应机制, 对于我国草地生态系统的恢复与管理具有重要意义。
关于羊草的功能性状对N素添加的响应及其适应策略, 已经开展了较多的研究, 但在不同组织水平下, 研究结果也不尽相同。例如, 在生态计量化学方面, 通过在内蒙古典型草原进行的养分添加实验研究发现: N添加提高了羊草的叶片N含量, 但对叶片P含量没有显著影响(白雪等, 2014 )。N添加也能显著提高羊草绿叶和衰老叶片的N、P含量, 从而降低叶片对N和P的再吸收, 整体上提高N和P在植物体内的周转速率(Lü et al ., 2013 )。根据生长速率假说(growth rate hypothesis), 羊草的生长速率与全P含量存在正相关关系, 而与N:P存在负相关关系, 不同来源的羊草种植在同一环境条件下, 来自N、P含量较高土壤的羊草具有较高的生长速率, 这可能是羊草对特定地域生境条件长期适应的结果(徐劲草和许新宜, 2013 )。也有研究发现, 羊草植株的N:P随着N添加在一定范围内保持稳定(Zhang et al ., 2004 )。从生理特性方面, Chen等(2005)研究发现, N添加能够提高羊草的最大光合速率, 但对羊草的净光合速率、蒸腾速率和气孔导度没有显著影响; 随着N添加梯度加大, 羊草的水分利用效率增加, 而N素利用效率降低。万宏伟等(2008)研究发现羊草通过增加比叶面积(SLA )和叶片N含量提高对光的竞争能力。白雪等(2014)研究发现, 羊草对N添加的响应因组织水平而异, 也受年际间降水变化的影响, 羊草通过增加SLA、 叶片大小和叶片N含量, 提高整体光合能力, 从而促进个体生长。这些结果主要是定性描述羊草对N变化的生理生态响应, 并没有在机理上对这些响应做出解释。
和N一样, P也是植物生长的主要养分限制因子, 因此N素和P素添加均被用于恢复退化的草地生态系统, 以恢复生态系统的生产力。目前, 关于羊草功能性状对养分添加响应的研究多集中在N素添加(Chen et al ., 2005 ; 万宏伟等, 2008 ; Bai et al ., 2010 ; Lan & Bai, 2012 ; Lü et al ., 2013 ), 而关于P添加以及N和P交互作用对羊草功能性状的影响研究得较少(黄菊莹等, 2012 ; 白雪等, 2014 ), 相关机制尚不十分清楚。白雪等(2014)发现, 尽管羊草草原主要受N素限制, 但在一定条件下也受P素限制。因此, 关于P添加对羊草植物功能性状的影响近年来逐渐受到关注。例如, 白雪等(2014)研究发现, P添加提高了羊草的叶片N和P含量; 黄菊莹等(2012)的研究表明随着P添加梯度增加, 羊草的根冠比降低。而 且, N供应水平的变化也影响了羊草对P的吸收 (Marklein & Houlton, 2012 ), 因此, N、P供应比例的改变可能会对植物功能性状产生较大的影响。通过控制实验, 开展不同N添加水平下植物对P添加梯度的响应与适应机制的研究, 有助于更好地理解植物对养分环境波动的适应能力。
目前, 已有的养分添加实验研究主要针对羊草地上部分的功能性状, 很少涉及羊草地下部分(如根系)的功能性状, 尤其是关于羊草的地上-地下功能性状及其关联的研究较少。Liu等(2010)的研究表明在群落、局地、区域和样带尺度上, 包括羊草在内的许多草原植物的地上和地下功能性状之间具有一定的联系, 如叶片N与根系N含量、SLA 与比根长(SRL )之间均呈显著的正相关关系。而且, 黄菊莹等(2012) 研究发现, 随着N和P添加量的增加, 羊草的地上、地下生物量和养分库呈现先增加后降低的趋势, 根冠比呈降低的趋势。因此, 养分添加可能会改变羊草的地上-地下功能性状及其关联, 但缺乏相关的研究来进行验证。开展关于羊草的地上-地下功能性状对N、P添加的响应及关联研究, 有助于全面理解和揭示羊草对养分添加的响应与适应机制, 为退化草地生态系统的恢复提供理论依据。
由于野外实验不可避免地要受到外界环境(如气候、土壤异质性等)和生物因素(如物种间的相互作用)的影响, 而室内栽培实验能够较好地避免这些因素的影响, 有利于揭示羊草对养分添加的响应与适应机制。为此, 我们设计了室内羊草栽培实验, 采用了低、中、高3个N和P添加梯度的交互处理, 以全面研究N、P及其交互作用对羊草整株性状、叶片和根系功能性状的影响, 本研究拟回答两个方面的科学问题: 1) N、P添加对羊草个体的地上与地下生物量及养分分配如何影响?对叶片(如SLA、 叶片N和P含量)与根系(如SRL、 根系N和P含量)性状如何影响? 2)羊草的地上与地下功能性状之间有何关联?是否存在权衡(trade-offs)或协同(synergies)关系?在低N和高N水平, 羊草对P添加的响应及适应机制是什么?
1 材料和方法
1.1 试验设计
本实验在中国科学院植物研究所的温室内进行。2010年4月初, 以蛭石作为培养基质, 在约25 ℃的温室内选取羊草种子进行幼苗萌发试验。待羊草幼苗长至约5 cm高时, 选取大小较一致的植株6-8株移栽至塑料盆(直径15 cm、高15 cm)中, 共准备100盆移栽好的羊草幼苗备用。
实验设计包括2个养分(N、P)添加处理, 每个养分设置3个水平, 其中N添加的3个浓度水平为: N1 = 50 mg·kg-1 、N2 = 100 mg·kg-1 、N3 = 250 mg·kg-1 , P添加的3个浓度水平为: P1 = 5 mg·kg-1 、P2 = 10 mg·kg-1 、P3 = 25 mg·kg-1 , 添加量均为纯N或纯P的质量与花盆内蛭石质量之比。本实验共设计10个处理, 每个处理均包含不同的N和P添加梯度, 具体为: N0P0 (对照)、N1P1、N1P2、N1P3、N2P1、N2P2、N2P3、N3P1、N3P2、N3P3, 每个处理10个重复。N和P添加的浓度水平是参考中国科学院内蒙古草原生态系统定位研究站自2000年设置的长期N素(0、1.75、5.25、10.5、17.5、28.0 g N· m-2 )和P素(0、2、4、8、16、32 g P2 O5 ·m-2 )添加实验平台(Bai et al ., 2010 )的实验处理设置的。由于野外实验是按施肥面积换算的, 与室内实验按盆栽土壤质量换算不同, 故而根据野外实验的养分处理水平, 本实验将N添加量设计为50、100、250 mg N·kg-1 , 而P添加量与N的比例按1:10计算, 设计为5、10、25 mg P·kg-1 。N、P养分的添加采用配制并稀释好的NH4 NO3 和Na2 HPO4 溶液, 同时在对照和所有处理中均添加了由ZnSO4 、MnCl2 、Na2 MoO4 、H3 BO3 配置的微量元素混合溶液, 以保证植物不受其他元素的限制。2010年5月初, 待羊草幼苗完全成活后, 根据N、P添加处理, 分6次每隔10天加入Na2 HPO4 和NH4 NO3 营养液。
1.2 植物功能性状测定
2010年7月初, N、P添加处理约60天后, 羊草叶片生长至成熟状态, 进行植物功能性状的观测。首先进行叶片光合生理性状的测定。利用LI-6400便携式光合作用测定系统 (LI-COR, Lincoln, USA), 在光强1500 µmol photons·m-2 ·s-1 、CO2 浓度400 µmol·mol-1 、叶片温度20 ℃及空气流通速率500 µmol·s-1 的控制条件下, 测定羊草叶片的净光合速率(P n )、蒸腾速率(T r )、气孔导度(G s )等气体交换参数, 进一步计算水分利用效率(WUE = P n /T r )。选取羊草最顶端完全展开的健康叶片, 每盆羊草测定1-2个叶片, 每个处理测定10盆重复。
羊草的光合生理性状测定完成后, 进行整株性状、叶片和根系性状的观测。对盆栽羊草进行破坏性取样, 将植株全部挖出后清洗干净, 将植株分为根、茎、叶3个部分, 分别称量其鲜质量。利用LI-3100 C型便携式叶面积仪(LI-COR, Lincoln, USA)测定叶片面积, 利用Winrhizo根系分析系统(Regent, Quebec, Canada)扫描测定根系的总长度, 然后将各部分样品于70 ℃烘干, 用1/10000天平称量。羊草个体的地上生物量为茎和叶的质量之和, 地下生物量为根系总质量, 总生物量为地上与地下生物量之和, 根冠比为地上与地下生物量之比。SLA 为叶片面积与叶片质量之比, SRL 为根系总长度与根系质量之比。进一步对叶片和根系样品进行N、P养分分析, 全N用CHNOS元素分析仪(vario EL III, Elementar Analysensysteme GmbH, Hanau, Germany)测定, 全P用钼锑钪比色法(6505紫外分光光度计, Jenway, Stone, UK)测定。羊草的叶片N、P总量分别为叶片生物量与N、P含量的乘积, 根系N、P总量分别为根系生物量与N、P含量的乘积, 羊草的N分配为叶片总N含量与根系总N含量之比, P分配为叶片总P含量与根系总P含量之比。
1.3 统计分析
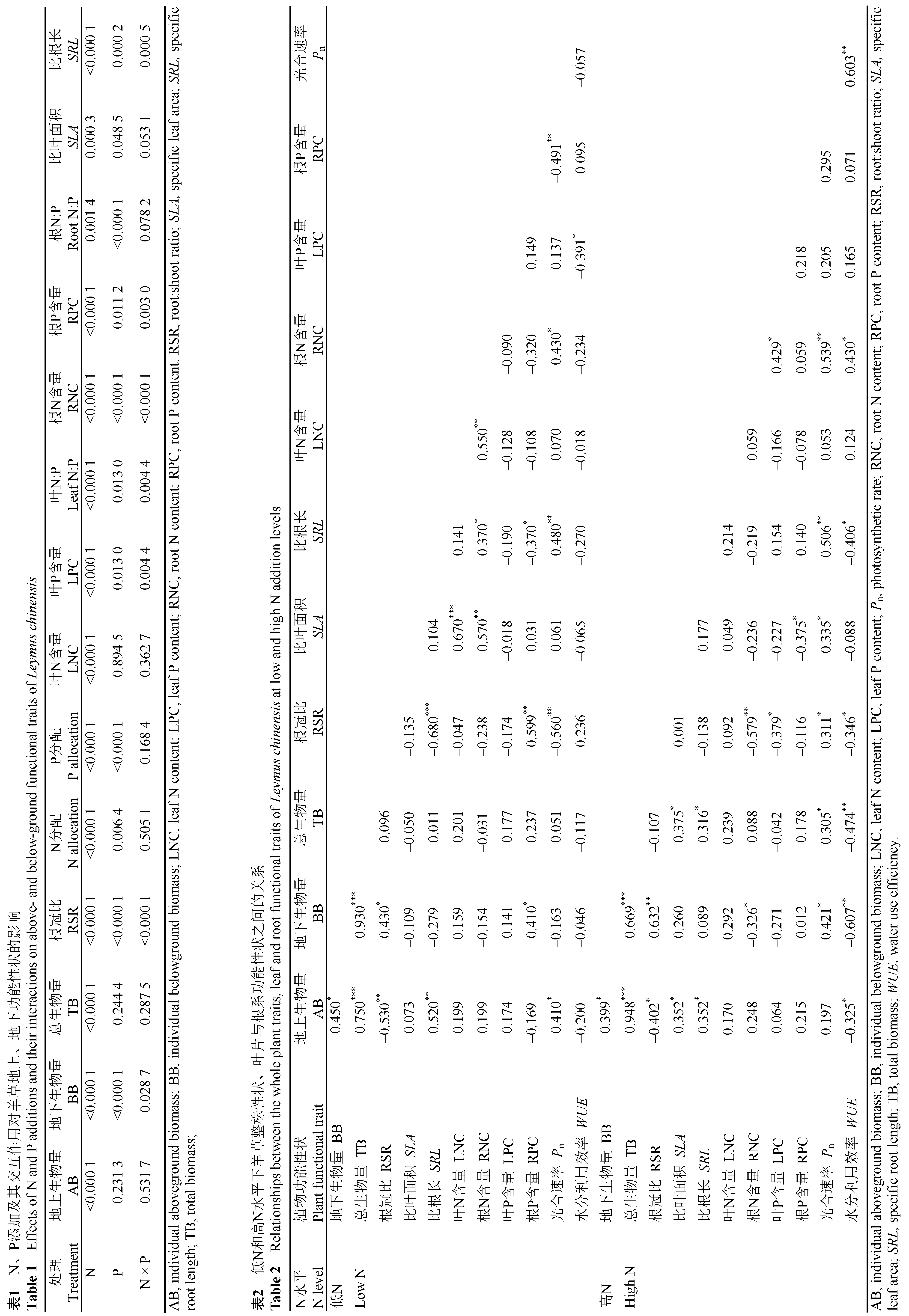
数据分析利用SAS 9.2 (SAS, Cary, USA)统计分析软件。采用双因素方差分析, 将不同水平的N (N1、N2、N3)、P (P1、P2、P3)添加处理作为固定因子, 分析不同N、P添加水平及交互作用对羊草功能性状的影响。同一N水平下, 不同P添加处理之间的差异采用单因素方差分析和最小显著差异(LSD )多重比较方法。用一般线性回归分析法分析所有处理下羊草的地上性状与地下性状之间的关系, 并分别对低N和高N水平所有P添加处理下, 羊草的整株性状与叶片、根系性状之间的关系进行相关分析。
2 结果和分析
2.1 羊草地上、地下生物量、总生物量和根冠比对N、P添加的响应
不同N、P添加处理的双因素方差分析结果表明: N添加对羊草个体的地上生物量、地下生物量、总生物量和根冠比影响显著; P添加及N、P交互处理对羊草个体的地下生物量和根冠比影响显著(表1 )。在低N水平, 羊草的地上生物量随着P添加梯度而升高, 在中、高N水平, 羊草的地上生物量在不同P处理中差异不显著(图1 )。与地上生物量相反, 羊草的地下生物量在低N水平对P添加的响应不显著, 而在中、高N水平, 地下生物量随着P添加梯度而降低。羊草的总生物量随着N添加梯度而显著上升(p < 0.0001), 但在相同水平的N添加处理中, 总生物量对不同P添加的响应没有显著差异。羊草根冠比随着N和P添加的梯度, 均显著降低(p < 0.0001), 在低、中、高3个N水平下, 羊草根冠比对P添加的响应均表现出P1 > P2 > P3的趋势。
2.2 叶片和根系生物量间的N、P分配
N和P添加对羊草N、P在叶片与根系生物量之间的分配(以总N、P质量比表示)均有显著影响(表1 )。在低N和中N水平, P添加显著提高了N向叶片生物量的分配比例; 而在高N水平, P添加对N分配的影响不显著, 但N向叶片生物量的分配比例显著高于低N和中N水平(图2 )。在低、中、高3个N水平下, P添加均显著提高了P向叶片生物量的分配比例, 且在高N水平的分配比例明显高于低N和中N水平。总的来看, 在高N水平, N向叶片生物量的分配比例比低N水平提高了4.2倍, 而P向叶片生物量的分配比例提高了2.8倍。
2.3 叶片和根系N、P含量和N:P比对N、P添加的响应
N添加对羊草的叶片和根系N含量、叶片和根系P含量, 以及叶片和根系N:P比均有显著影响, 而P添加及N、P交互处理对根系N含量、叶片和根系P含量, 以及叶片和根系N:P比影响显著(表1 )。叶片N含量随着N添加而显著升高(p < 0.0001), 在低、中、高3个N水平下, 叶片N含量的平均值分别为2.02%、2.57%和4.27%, 但叶片N含量对P添加响应不显著(图2 )。根系N含量也随着N添加而显著升高(p < 0.0001), 3个N水平中, 根系N含量的平均值分别为0.97%、1.09%和1.98%, 且在高N水平下根系N含量随着P添加而增加。叶片和根系P含量对N和P添加的总体响应均显著, 在低N和高N水平, 叶片P含量随着P添加而增加, 而在低N和中N水平, 根系P含量随着P添加而降低。总体来看, 羊草叶片的N含量显著高于根系N含量, 而叶片P和根系P含量大致相当。叶片和根系对N添加的响应趋势较为一致, 而对P添加的响应有所不同。羊草叶片的N:P (10-15)远高于根系的N:P (4.5-9.0)。在低N和高N水平, 叶片N:P随着P添加而降低, 而在低N和中N水平, 根系N:P随着P添加而增加(图3 )。
2.4 SLA 和SRL 对N、P添加的响应
N和P添加对羊草的SLA 和SRL 均有显著影响, N、P交互处理仅对羊草的SRL 影响显著(表1 )。SLA 在低、中N水平对P添加的响应不明显, 而在高N水平有降低的趋势(图4 )。SRL 对N和P添加的响应明显强于SLA, 在低N水平, SRL 随着P添加梯度而增加, 但在高N水平, 则有降低的趋势。
图1 氮、磷添加对羊草个体的地上生物量(A)、地下生物量(B)、总生物量(C)和根冠比(D)的影响(平均值±标准误差)。不同字母代表在相同N添加水平下, 不同P添加处理之间差异显著(p < 0.05), p 值为显著性水平, ns表示P处理间差异不显著。N0P0, 对照; N1、N2、N3分别表示低、中、高N水平; P1、P2、P3分别表示低、中、高P水平。
Fig. 1 Effects of N and P additions on individual aboveground biomass (A), belowground biomass (B), total biomass (C), and root: shoot ratio (D) of Leymus chinensis (mean ± SE ). Different letters indicate significant difference (p < 0.05) among different P treatments at the same N level. p values indicate significant levels, and ns indicates non-significant difference among P treatments. N0P0, control; N1, N2, N3 represent low, moderate and high N levels, and P1, P2, P3 represent low, moderate and high P levels.
图2 氮、磷添加对羊草叶片与根系生物量N、P分配(A, B)的影响(平均值±标准误差)。生物量N、P分配分别为叶片与根系总N、P质量之比。不同字母代表在相同N添加水平下, 不同P添加处理之间差异显著(p < 0.05), p 值为显著性水平, ns表示P处理间差异不显著。N0P0, 对照; N1、N2、N3分别表示低、中、高N水平; P1、P2、P3分别表示低、中、高P水平。
Fig. 2 Effects of N and P additions on N (A) and P (B) allocation between leaf and root biomass of Leymus chinensis (mean ± SE ). N allocation is calculated as the ratio of leaf N biomass to root N biomass, and P allocation is the ratio of leaf P biomass to root P biomass. Different letters indicate significant difference (p < 0.05) among different P treatments at the same N level. p values indicate significant levels, and ns indicates non-significant difference among P treatments. N0P0, control; N1, N2, N3 represent low, moderate and high N levels, and P1, P2, P3 represent low, moderate and high P levels.
图3 氮、磷添加对羊草叶片(A)和根系(B) N、P含量及N:P比的影响(平均值±标准误差)。不同小写字母代表在相同N添加水平下, 不同P添加处理间差异显著(p < 0.05), P 值为显著性水平, ns表示P处理间差异不显著。N0P0, 对照; N1、N2、N3分别表示低、中、高N水平; P1、P2、P3分别表示低、中、高P水平。
Fig. 3 Effects of N and P additions on leaf (A) and root (B) N, P, and N:P ratios of Leymus chinensis (mean ± SE ). Different letters indicate significant difference (p < 0.05) among different P treatments at the same N level. P values indicate significant levels, and ns indicates non-significant difference among P treatments. N0P0, control; N1, N2, N3 represent low, moderate and high N levels, and P1, P2, P3 represent low, moderate and high P levels.
2.5 地上性状与地下性状之间的关系
对所有处理下羊草的地上与地下性状的相关分析表明, 羊草的地上生物量与地下生物量之间没有显著的相关性, 而SLA 与SRL (R 2 = 0.04, p = 0.0558)、叶片N与根系N含量(R 2 = 0.82, p < 0.0001)、叶片P与根系P含量(R 2 = 0.28, p < 0.0001)之间均呈显著的正相关关系(图5 )。
2.6 低N和高N水平下植物功能性状之间的关系
整株性状与叶片、根系性状的相关分析表明, 在低N水平的所有P添加处理中, 羊草的地上生物量与P n 和SRL 正相关, 而地下生物量、根冠比均与根系P含量正相关(表2 )。此外, 叶片与根系性状之间的相关分析表明SLA 与叶片N (r = 0.67)和根系N含量(r = 0.57)正相关, SRL 与根系N含量(r = 0.37)正相关, 而与根系P含量(r = -0.37)负相关, P n 与根系N含量正相关(r = 0.49)。
图4 氮、磷添加对羊草的比叶面积(A)和比根长(B)影响(平均值±标准误差)。不同字母代表在相同N添加水平下, 不同P添加处理之间差异显著(p < 0.05), p 值为显著性水平, ns表示P处理间差异不显著。N0P0, 对照; N1, N2, N3分别表示低、中、高N水平; P1, P2, P3分别表示低、中、高P水平。
Fig. 4 Effects of N and P additions on specific leaf area (A) and specific root length (B) of Leymus chinensis (mean ± SE ). Different letters indicate significant difference (p < 0.05) among different P treatments at the same N level. p values indicate significant levels, and ns indicates non-significant difference among P treatments. N0P0, control; N1, N2, N3 represent low, moderate and high N levels, and P1, P2, P3 represent low, moderate and high P levels.
图5 羊草个体地上与地下生物量(A)、比叶面积与比根长(B)、叶片与根系N、P含量(C、D)之间的关系。
Fig. 5 Relationships between individual aboveground and belowground biomass (A), specific leaf area and specific root length (B), leaf N and root N contents (C), leaf P and root P contents (D) of Leymus chinensis .
在高N水平的所有P添加处理中, 羊草的地上生物量、总生物量均与SLA 和SRL 正相关, 而与WUE 负相关, 总生物量还与P n 负相关; 羊草的地下生物量、根冠比均与根系N含量负相关(表2 )。叶片和根系性状之间的相关分析表明, SLA 与P n (r = -0.34)和根系P含量(r = -0.38)负相关, 而P n 与根系N (r = 0.54)含量正相关。
3 讨论
以往关于羊草对养分添加的实验研究多是在野外的自然生境中进行的(Chen et al ., 2005 ; 万宏伟等, 2008 ; Lan & Bai, 2012 ; Lü et al ., 2013 ; 白雪等, 2014 ), 或是通过盆栽实验, 但只针对某一方面的生理生态特性进行研究(王云龙等, 2004 ; Xu & Zhou, 2006 )。相比以往研究, 本研究通过盆栽实验, 利用温室控制稳定的温度和湿度, 添加定量的有效态N和P, 排除了气候变化、环境异质性和群落内物种竞争等干扰因素。本实验设计了低、中、高3个N和P梯度及其交互作用, 以更好地模拟养分供应的不同比例, 较为系统地测定了羊草的地上、地下关键功能性状, 以期更好地揭示羊草对不同养分环境的响应及适应机制。
3.1 N、P添加对羊草生物量分配和养分分配的影响及机制
我们的结果表明, 羊草的地上生物量主要受N添加的影响, 高N水平下, 羊草的地上生物量约为低N水平的3.5倍, 仅在低N水平下, P添加会提高羊草的地上生物量, 说明在N供应水平较低的情况下, P添加对羊草生长有一定的促进作用。羊草的总生物量也主要受N添加的影响, 中N和高N水平羊草的总生物量约为低N水平的2.0-3.0倍。这些结果表明, 羊草的个体生长主要受N素限制, 这与基于野外养分添加实验的研究结果较为一致, 例如: 白雪等(2014) 研究发现N添加对羊草生长具有明显的促进效应, 使其个体生物量显著增加; 潘庆民等(2005) 研究表明N添加显著提高了羊草群落的地上生物量。与地上生物量相反, 羊草的地下生物量主要受P添加的影响, 尤其在中N和高N水平, P添加会显著降低羊草的地下生物量。羊草的根冠比受N、P添加的共同影响, 随着N和P添加的梯度, 根冠比显著降低, 表明N、P添加均促进了植物向地上生物量的分配。此结果与黄菊莹等(2012)通过盆栽实验研究羊草对N、P添加的响应结果较为一致。通过分析N、P在叶片与根系生物量之间的分配, 我们的研究发现N、P添加均显著促进了羊草向叶片生物量的N、P分配, 在高N水平, N、P向叶片生物量的分配比例比低N水平分别高出4.2倍和2.8倍。而且, 羊草的叶片N含量显著高于根系N含量, N、P添加提高了叶片P含量, 但降低了根系P含量, 也表明N、P添加促进了羊草向叶片生物量的N、P分配。Müller等(2000)也认为在养分条件较好时, 植物倾向于将生物量较多地分配于地上部分, 在养分条件较差时则倾向于分配至地下部分。
羊草N、P向叶片的分配比例增加, 主要是因为随着N、P添加, 羊草由对地下养分的竞争逐渐转化为对地上光资源的竞争(Pan et al ., 2011 ; Lan & Bai, 2012 )。这不仅是羊草对养分环境波动的适应, 也有利于其在自然群落中的竞争。因为随着N和P添加, 根系的养分吸收能力逐渐过剩, 将更多的资源分配给地上部分, 植株变得高大, 以利于获得更多的光照(Lan & Bai, 2012 )。SLA 和SRL 反映了植物对光强和土壤养分的获取能力(Cornelissen et al ., 2003 )。本研究中, 羊草SRL 在中N水平最低, 而在低N和高N水平较高。其原因可能是, 在中N水平, 羊草对养分资源的吸收高于低N水平, 因此羊草降低SRL 以适应较高浓度的养分环境。随着N添加, 高N水平促进了植株的养分周转(Marklein & Houlton, 2012 ), 细根比例增加以满足植物快速生长的养分需求, 因此羊草SRL 又随之增加。本研究中, 羊草的SLA 较为稳定, 在低N、P水平, 植物分配较多的资源于叶片以提高其最大光合潜能, 而随着N、P添加, 羊草生长不受养分限制, 其增加N、P分配也不能提高光合速率, 因而SLA 较为稳定。万宏伟等(2008)认为, 随着N添加导致光资源竞争加剧, 不同物种对光资源的竞争策略和竞争力有显著差异, 而羊草能够通过提高SLA 和叶片N含量提高其对光资源的利用。
我们的研究表明, 相对于地上性状, P添加对羊草的地下性状影响更大, 其原因可能是, 羊草是根系与丛枝菌根真菌(AMF)共生的物种, 而菌根真菌更有利于根系对P的吸收(Li & Feng, 2001 )。已有研究表明, 不同植物的共生菌根效应存在很大差异, 可以是正效应、中性或负效应, 与植物生长的养分环境有关。在土壤有效养分供应充足的情况下, 菌根共生对植物生长没有积极影响, 甚至会导致植物生物量下降(Hart et al ., 2003 ; 雷垚等, 2013 )。本研究中, 在中、高N 水平, P 添加显著降低了羊草的根系P 含量和地下生物量, 其原因可能是在N供应较高条件下, 菌根真菌对P吸收的作用有限, 而P的过量添加抑制了根系生长。植物功能性状之间的权衡(tradeoffs)或协同(synergies)关系, 反映了植物为适应环境变化所采取的策略(Lavorel & Grigulis, 2012 )。本研究中, 尽管羊草的地上生物量与地下生物量之间没有显著的相关性, 但从总的趋势看, 沿着N、P添加梯度, 羊草的地上生物量增加, 而地下生物量降低, 根冠比也呈降低趋势, 表明羊草在地上与地下部分的资源分配方面采取了一定的权衡策略。羊草的叶片N与根系N含量、叶片P与根系P含量之间均呈显著的正相关关系, 其原因主要是根系从土壤中吸收N、P进而传输到叶片, 因而叶片与根系养分表现出高度的协同性。羊草的SLA 与SRL 之间呈较弱的正相关关系, 表明羊草叶片与根系在资源获取和利用方面具有相对的独立性。
3.2 低N和高N水平下羊草对P添加的适应机制
在低N水平, 随着P添加梯度, 羊草的地上生物量、叶片P含量和SRL 增加, 而地下生物量、叶片和根系N含量和SLA 变化不大。表明在低N水平, P添加促进了地上部分生长, 而对地下部分影响不大。羊草的地上生物量与P n 和SRL 呈正相关关系, 而地下生物量与根系P含量呈正相关关系, SRL 与根系N含量呈正相关关系。这些结果表明, 羊草主要通过提高光合能力和根系对N的获取能力促进地上部分的生长, 而根系对P的吸收有利于地下部分的生长。
在高N水平, 随着P添加梯度, 羊草的地上生物量和叶片N含量无明显变化, 而地下生物量降低, 叶片P含量和根系N含量增加。羊草的地上生物量、总生物量均与SLA 和SRL 呈正相关关系, 而与WUE 呈负相关关系, 总生物量还与P n 呈负相关关系, 羊草的地下生物量与根系N含量呈负相关关系。这些结果表明在高N水平, P添加对羊草的个体生长无明显促进作用, 甚至地下部分明显受到P素抑制, 羊草主要通过保持较高的SLA 和SRL 提高对光资源的截获能力和根系对N的获取和吸收能力维持地上部分的生长。
羊草在对养分添加做出响应的同时, 虽然其生物量和生理性状有显著响应, 但也具有保持生物计量化学稳定的特性, 即相对于变化的外界养分供应而言, 植物在一定范围内具有保持自身N:P稳定的能力(Elser et al ., 2000 ; Zhang et al ., 2003 )。本实验结果也表明, 尽管羊草组织(叶片和根系)的N或P含量对养分添加有着较明显的响应, 但羊草的叶片N:P始终保持在12-15之间, 而在较高的N和P添加水平, 羊草的N:P基本维持在14-15左右, 与传统的养分限制理论中以N:P为14或16作为区分N或P限制的阈值较为相符(Koerselman & Meuleman, 1996 )。我们的研究还发现在盆栽实验中, N和P的作用在一定程度上是互补的。一般认为叶片N含量是直接与植物光合能力相关的指标, 本实验中高N处理下羊草叶片的N含量显著高于其他处理, 但从光合速率的数据看, 高N下叶片光合速率并没有随之升高, 而是随着P添加的增加而显著上升, 说明在本实验中, P可能是羊草光合作用的重要限制因子。早期的一些研究发现部分植物的光合作用是受到P限制的(Terry & Ulrich, 1973 ; Lapointe, 1987 ), 而Reich等(2009)通过对多个生态系统的整合分析, 发现整体来看叶片N和P含量均与其最大光合速率显著相关(p < 0.0001), 但全因子的回归模型显示N是主因子(p < 0.0001, R 2 = 0.52), 而N和P有着显著的交互 作用。
4 结论
我们的研究表明: 羊草个体的地上生物量和总生物量主要受N添加的影响, 而地下生物量主要受P添加的影响, 尤其在中N和高N水平, P添加显著降低了羊草的地下生物量。N、P添加降低了羊草的根冠比, 促进了羊草生物量向地上部分的分配和N、P向叶片的分配。相对于地上性状, P添加对羊草的地下性状影响更大, 在低N和高N条件下, 羊草对P添加的适应机制不同。羊草的SLA 与SRL 之间呈较弱的正相关关系, 表明叶片与根系在资源获取和利用方面具有相对的独立性。我们的研究结果对退化草地生态系统的恢复与管理具有重要的指导意义。采用养分添加措施时, 应考虑草地生态系统自身的养分状况, 设置适当的N、P肥施用比例。对于养分贫瘠的草地, 施用N肥是提高草地生产力的首选措施; 对于N素不匮乏的草地, 适当添加P肥也有助于生产力的提高; 但过量添加N、P肥, 对于生产力的提高效应不大, 尤其是过量添加P肥甚至会抑制地下部分的生长, 造成肥料浪费和环境污染。另外, N、P添加能够提高草地生产力, 但同时也改变了地上-地下生物量分配, 可能引起光资源或水分的相对限制, 因此利用养分添加管理手段还需要综合考虑生态系统功能的平衡。
致谢 中国科学院植物研究所兰志春、邢稳和李建 军博士生在本实验中给予了大力帮助, 在此表示感谢。
The authors have declared that no competing interests exist.
作者声明没有竞争性利益冲突.
参考文献
文献选项
[1]
Bai X Cheng JH Zheng SX Zhan SX Bai YF 2014 ). Ecophysiological responses of Leymus chinensis to nitrogen and phosphorus additions in a typical steppe.
Chinese Journal of Plant Ecology , 38 , 103 -115 . (in Chinese with English abstract)
[本文引用: 4]
[白雪 , 程军回 , 郑淑霞 , 詹书侠 , 白永飞 (2014 ). 典型草原建群种羊草对氮磷添加的生理生态响应
. 植物生态学报 , 38 , 103 -115 .]
[本文引用: 4]
[2]
Bai YF Wu JG Clark CM Naeem S Pan QM Huang JH Zhang LX Han XG 2010 ). Tradeoffs and thresholds in the effects of nitrogen addition on biodiversity and ecosystem functioning: Evidence from Inner Mongolia grasslands.
Global Change Biology , 16 , 358 -372 .
[本文引用: 2]
[3]
Chen SP Bai YF Zhang LX Han XG 2005 ). Comparing physiological responses of two dominant grass species to nitrogen addition in Xilin River Basin of China.
Environmental and Experimental Botany , 53 , 65 -75 .
[本文引用: 2]
[4]
Cornelissen JHC Lavorel S Garnier E Díaz S Buchmann N Gurvich DE Reich PB ter Steege H Morgan HD van der Heijden MGA Pausas JG Poorter H 2003 ). A handbook of protocols for standardised and easy measurement of plant functional traits worldwide.
Australian Journal of Botany , 51 , 335 -380 .
[本文引用: 1]
[5]
Elser JJ Fagan WF Denno RF Dobberfuhl DR Folarin A Huberty A Interlandi S Kilham SS McCauley E Schulz KL Siemann EH Sterner RW 2000 ). Nutritional constraints in terrestrial and freshwater food webs.
Nature , 408 , 578 -580 .
[本文引用: 1]
[6]
Hart MM Reader RJ Klironomos JN 2003 ). Plant coexistence mediated by arbuscular mycorrhizal fungi.
Trends in Ecology & Evolution , 18 , 418 -423 .
[本文引用: 1]
[7]
Huang JY Xu P Yu HL Yuan ZY Li LH 2012 ). Responses of biomass, nutrient allocation of Leymus chinensis along N, P and water gradients.
Pratacultural Science , 29 , 1589 -1595 . (in Chinese with English abstract)
[本文引用: 2]
[黄菊莹 , 徐鹏 , 余海龙 , 袁志友 , 李凌浩 (2012 ). 羊草生物量和养分分配对养分和水分添加的响应
. 草业科学 , 29 , 1589 -1595 .]
[本文引用: 2]
[8]
Koerselman W Meuleman AFM 1996 ). The vegetation N:P ratio: A new tool to detect the nature of nutrient limitation.
Journal of Applied Ecology , 33 , 1441 -1450 .
[本文引用: 1]
[9]
Lan ZC Bai YF 2012 ). Testing mechanisms of N-enrichment- induced species loss in a semiarid Inner Mongolia grassland: Critical thresholds and implications for long-term ecosystem responses.
Philosophical Transactions of the Royal Society B: Biological Sciences , 367 , 3125 -3134 .
[本文引用: 4]
[10]
Lapointe BE 1987 ). Phosphorus-and nitrogen-limited photosynthesis and growth of Gracilaria tikvahiae (Rhodophyceae) in the Florida Keys: An experimental field study.
Marine Biology , 93 , 561 -568 .
[本文引用: 1]
[11]
Lavorel S Grigulis K 2012 ). How fundamental plant functional trait relationships scale-up to trade-offs and synergies in ecosystem services.
Journal of Ecology , 100 , 128 -140 .
[本文引用: 1]
[12]
Lei Y Hao ZP Chen BD 2013 ). Effects of indigenous AM fungi and neighboring plants on the growth and phosphorus nutrition of Leymus chinensis.
Acta Ecologica Sinica , 33 , 1071 -1079 . (in Chinese with English abstract)
[本文引用: 1]
[雷垚 , 郝志鹏 , 陈保冬 (2013 ). 土著菌根真菌和混生植物对羊草生长和磷营养的影响
. 生态学报 , 33 , 1071 -1079 .]
[本文引用: 1]
[13]
Li XL Feng G 2001). Eco-Physiology of Arbuscular Mycorrhiza . Sino-Culture Press , Beijing . 178 -199 .
[14]
Li YH 1993 ). Grazing dynamics of the species diversity in Aneurolepidium chinense steppe and Stipa grandis steppe.
Acta Botanica Sinica , 35 , 877 -884 . (in Chinese with English abstract)
[本文引用: 1]
[李永宏 (1993 ). 放牧影响下羊草草原和大针茅草原植物多样性的变化
. 植物学报 , 35 , 877 -884 .]
[本文引用: 1]
[15]
Liu GF Freschet GT Pan X Cornelissen JHC Li Y Dong M 2010 ). Coordinated variation in leaf and root traits across multiple spatial scales in Chinese semi-arid and arid ecosystems.
New Phytologist , 188 , 543 -553 .
[16]
Lü XT Reed S Yu Q He NP Wang ZW Han XG 2013 ). Convergent responses of nitrogen and phosphorus resorption to nitrogen inputs in a semiarid grassland.
Global Change Biology , 19 , 2775 -2784 .
[本文引用: 3]
[17]
Marklein AR Houlton BZ 2012 ). Nitrogen inputs accelerate phosphorus cycling rates across a wide variety of terrestrial ecosystems.
New Phytologist , 193 , 696 -704 .
[本文引用: 2]
[18]
Müller I Schmid B Weiner J 2000 ). The effect of nutrient availability on biomass allocation patterns in 27 species of herbaceous plants.
Perspectives in Plant Ecology, Evolution and Systematics , 3 , 115 -127 .
[19]
Pan QM Bai YF Han XG Yang JC 2005 ). Effects of nitrogen additions on a Leymus chinensis population in typical steppe of Inner Mongolia.
Acta Phytoecologica Sinica , 29 , 311 -317 . (in Chinese with English abstract)
[本文引用: 2]
[潘庆民 , 白永飞 , 韩兴国 , 杨景成 (2005 ). 氮素对内蒙古典型草原羊草种群的影响
. 植物生态学报 , 29 , 311 -317 .]
[本文引用: 2]
[20]
Pan QM Bai YF Wu JG Han XG 2011 ). Hierarchical plant responses and diversity loss after nitrogen addition: Testing three functionally-based hypotheses in the Inner Mongolia grassland.
PLoS ONE , 6 , e20078 . doi: 10.1371/jour- nal.pone.0020078 .
[本文引用: 1]
[21]
Reich PB Oleksyn J Wright IJ 2009 ). Leaf phosphorus influences the photosynthesis-nitrogen relation: A cross-biome analysis of 314 species.
Oecologia , 160 , 207 -212 .
[22]
Terry N Ulrich A 1973 ). Effects of phosphorus deficiency on the photosynthesis and respiration of leaves of sugar beet.
Plant Physiology , 51 , 43 -47 .
[本文引用: 1]
[23]
Wan HW Yang Y Bai SQ Xu YH Bai YF 2008 ). Variations in leaf functional traits of six species along a nitrogen addition gradient in Leymus chinensis steppe in Inner Mongolia. Journal of Plant Ecology (
Chinese Version ), 32 , 611 -621 . (in Chinese with English abstract)
[本文引用: 2]
[万宏伟 , 杨阳 , 白世勤 , 徐云虎 , 白永飞 (2008 ). 羊草草原群落6种植物叶片功能特性对氮素添加的响应
. 植物生态学报 , 32 , 611 -621 .]
[本文引用: 2]
[24]
Wang RZ 1997 ). The niche breaths and niche overlaps of main plant populations in Leymus chinensis grassland for grazing.
Acta Phytoecologica Sinica , 21 , 304 -311 . (in Chinese with English abstract)
[本文引用: 1]
[王仁忠 (1997 ). 放牧影响下羊草草地主要植物种群生态位宽度与生态位重叠的研究
. 植物生态学报 , 21 , 304 -311 .]
[本文引用: 1]
[25]
Wang YH He XY Zhou GS 2002 ). Study on the responses of Leymus chinensis steppe to grazing in Songnen Plain.
Acta Agrestia Sinica , 10 , 45 -49 . (in Chinese with English abstract)
[本文引用: 1]
[王玉辉 , 何兴元 , 周广胜 (2002 ). 放牧强度对羊草草原的影响
. 草地学报 , 10 , 45 -49 .]
[本文引用: 1]
[26]
Wang YL Xu ZZ Zhou GS 2004 ). Changes in biomass allocation and gas exchange characteristics of Leymus chinensis in response to soil water stress.
Acta Phytoecologica Sinica , 28 , 803 -809 . (in Chinese with English abstract)
[本文引用: 1]
[王云龙 , 许振柱 , 周广胜 (2004 ). 水分胁迫对羊草光合产物分配及其气体交换特征的影响
. 植物生态学报 , 28 , 803 -809 .]
[本文引用: 1]
[27]
Xu JC Xu XY 2013 ). A study on growth rate and the growth rate hypothesis in Leymus chinensis.
Pratacultural Science , 30 , 74 -79 . (in Chinese with English abstract)
[本文引用: 1]
[徐劲草 , 许新宜 (2013 ). 羊草生长率的研究和生长率假说的验证
. 草业科学 , 30 , 74 -79 .]
[本文引用: 1]
[28]
Xu ZZ Zhou GS 2006 ). Combined effects of water stress and high temperature on photosynthesis, nitrogen metabolism and lipid peroxidation of a perennial grass Leymus chinensis.
Planta , 224 , 1080 -1090 .
[本文引用: 1]
[29]
Zhang LX Bai YF Han XG 2003 ). Application of N:P stoichiometry to ecology studies.
Acta Botanica Sinica , 45 , 1009 -1018 .
[本文引用: 1]
[30]
Zhang LX Bai YF Han XG 2004 ). Differential responses of N:P stoichiometry of Leymus chinensis and Carex korshinskyi to N additions in a steppe ecosystem in Nei Mongol.
Acta Botanica Sinica , 46 , 259 -270 .
[本文引用: 1]
典型草原建群种羊草对氮磷添加的生理生态响应
4
2014
... 关于羊草的功能性状对N素添加的响应及其适应策略, 已经开展了较多的研究, 但在不同组织水平下, 研究结果也不尽相同.例如, 在生态计量化学方面, 通过在内蒙古典型草原进行的养分添加实验研究发现: N添加提高了羊草的叶片N含量, 但对叶片P含量没有显著影响(白雪等, 2014 ).N添加也能显著提高羊草绿叶和衰老叶片的N、P含量, 从而降低叶片对N和P的再吸收, 整体上提高N和P在植物体内的周转速率(Lü et al ., 2013 ).根据生长速率假说(growth rate hypothesis), 羊草的生长速率与全P含量存在正相关关系, 而与N:P存在负相关关系, 不同来源的羊草种植在同一环境条件下, 来自N、P含量较高土壤的羊草具有较高的生长速率, 这可能是羊草对特定地域生境条件长期适应的结果(徐劲草和许新宜, 2013 ).也有研究发现, 羊草植株的N:P随着N添加在一定范围内保持稳定(Zhang et al ., 2004 ).从生理特性方面, Chen等(2005)研究发现, N添加能够提高羊草的最大光合速率, 但对羊草的净光合速率、蒸腾速率和气孔导度没有显著影响; 随着N添加梯度加大, 羊草的水分利用效率增加, 而N素利用效率降低.万宏伟等(2008)研究发现羊草通过增加比叶面积(SLA )和叶片N含量提高对光的竞争能力.白雪等(2014)研究发现, 羊草对N添加的响应因组织水平而异, 也受年际间降水变化的影响, 羊草通过增加SLA、 叶片大小和叶片N含量, 提高整体光合能力, 从而促进个体生长.这些结果主要是定性描述羊草对N变化的生理生态响应, 并没有在机理上对这些响应做出解释. ...
... 和N一样, P也是植物生长的主要养分限制因子, 因此N素和P素添加均被用于恢复退化的草地生态系统, 以恢复生态系统的生产力.目前, 关于羊草功能性状对养分添加响应的研究多集中在N素添加(Chen et al ., 2005 ; 万宏伟等, 2008 ; Bai et al ., 2010 ; Lan & Bai, 2012 ; Lü et al ., 2013 ), 而关于P添加以及N和P交互作用对羊草功能性状的影响研究得较少(黄菊莹等, 2012 ; 白雪等, 2014 ), 相关机制尚不十分清楚.白雪等(2014)发现, 尽管羊草草原主要受N素限制, 但在一定条件下也受P素限制.因此, 关于P添加对羊草植物功能性状的影响近年来逐渐受到关注.例如, 白雪等(2014)研究发现, P添加提高了羊草的叶片N和P含量; 黄菊莹等(2012)的研究表明随着P添加梯度增加, 羊草的根冠比降低.而 且, N供应水平的变化也影响了羊草对P的吸收 (Marklein & Houlton, 2012 ), 因此, N、P供应比例的改变可能会对植物功能性状产生较大的影响.通过控制实验, 开展不同N添加水平下植物对P添加梯度的响应与适应机制的研究, 有助于更好地理解植物对养分环境波动的适应能力. ...
... 以往关于羊草对养分添加的实验研究多是在野外的自然生境中进行的(Chen et al ., 2005 ; 万宏伟等, 2008 ; Lan & Bai, 2012 ; Lü et al ., 2013 ; 白雪等, 2014 ), 或是通过盆栽实验, 但只针对某一方面的生理生态特性进行研究(王云龙等, 2004 ; Xu & Zhou, 2006 ).相比以往研究, 本研究通过盆栽实验, 利用温室控制稳定的温度和湿度, 添加定量的有效态N和P, 排除了气候变化、环境异质性和群落内物种竞争等干扰因素.本实验设计了低、中、高3个N和P梯度及其交互作用, 以更好地模拟养分供应的不同比例, 较为系统地测定了羊草的地上、地下关键功能性状, 以期更好地揭示羊草对不同养分环境的响应及适应机制. ...
... 我们的结果表明, 羊草的地上生物量主要受N添加的影响, 高N水平下, 羊草的地上生物量约为低N水平的3.5倍, 仅在低N水平下, P添加会提高羊草的地上生物量, 说明在N供应水平较低的情况下, P添加对羊草生长有一定的促进作用.羊草的总生物量也主要受N添加的影响, 中N和高N水平羊草的总生物量约为低N水平的2.0-3.0倍.这些结果表明, 羊草的个体生长主要受N素限制, 这与基于野外养分添加实验的研究结果较为一致, 例如: 白雪等(2014) 研究发现N添加对羊草生长具有明显的促进效应, 使其个体生物量显著增加; 潘庆民等(2005) 研究表明N添加显著提高了羊草群落的地上生物量.与地上生物量相反, 羊草的地下生物量主要受P添加的影响, 尤其在中N和高N水平, P添加会显著降低羊草的地下生物量.羊草的根冠比受N、P添加的共同影响, 随着N和P添加的梯度, 根冠比显著降低, 表明N、P添加均促进了植物向地上生物量的分配.此结果与黄菊莹等(2012)通过盆栽实验研究羊草对N、P添加的响应结果较为一致.通过分析N、P在叶片与根系生物量之间的分配, 我们的研究发现N、P添加均显著促进了羊草向叶片生物量的N、P分配, 在高N水平, N、P向叶片生物量的分配比例比低N水平分别高出4.2倍和2.8倍.而且, 羊草的叶片N含量显著高于根系N含量, N、P添加提高了叶片P含量, 但降低了根系P含量, 也表明N、P添加促进了羊草向叶片生物量的N、P分配.Müller等(2000)也认为在养分条件较好时, 植物倾向于将生物量较多地分配于地上部分, 在养分条件较差时则倾向于分配至地下部分. ...
典型草原建群种羊草对氮磷添加的生理生态响应
4
2014
... 关于羊草的功能性状对N素添加的响应及其适应策略, 已经开展了较多的研究, 但在不同组织水平下, 研究结果也不尽相同.例如, 在生态计量化学方面, 通过在内蒙古典型草原进行的养分添加实验研究发现: N添加提高了羊草的叶片N含量, 但对叶片P含量没有显著影响(白雪等, 2014 ).N添加也能显著提高羊草绿叶和衰老叶片的N、P含量, 从而降低叶片对N和P的再吸收, 整体上提高N和P在植物体内的周转速率(Lü et al ., 2013 ).根据生长速率假说(growth rate hypothesis), 羊草的生长速率与全P含量存在正相关关系, 而与N:P存在负相关关系, 不同来源的羊草种植在同一环境条件下, 来自N、P含量较高土壤的羊草具有较高的生长速率, 这可能是羊草对特定地域生境条件长期适应的结果(徐劲草和许新宜, 2013 ).也有研究发现, 羊草植株的N:P随着N添加在一定范围内保持稳定(Zhang et al ., 2004 ).从生理特性方面, Chen等(2005)研究发现, N添加能够提高羊草的最大光合速率, 但对羊草的净光合速率、蒸腾速率和气孔导度没有显著影响; 随着N添加梯度加大, 羊草的水分利用效率增加, 而N素利用效率降低.万宏伟等(2008)研究发现羊草通过增加比叶面积(SLA )和叶片N含量提高对光的竞争能力.白雪等(2014)研究发现, 羊草对N添加的响应因组织水平而异, 也受年际间降水变化的影响, 羊草通过增加SLA、 叶片大小和叶片N含量, 提高整体光合能力, 从而促进个体生长.这些结果主要是定性描述羊草对N变化的生理生态响应, 并没有在机理上对这些响应做出解释. ...
... 和N一样, P也是植物生长的主要养分限制因子, 因此N素和P素添加均被用于恢复退化的草地生态系统, 以恢复生态系统的生产力.目前, 关于羊草功能性状对养分添加响应的研究多集中在N素添加(Chen et al ., 2005 ; 万宏伟等, 2008 ; Bai et al ., 2010 ; Lan & Bai, 2012 ; Lü et al ., 2013 ), 而关于P添加以及N和P交互作用对羊草功能性状的影响研究得较少(黄菊莹等, 2012 ; 白雪等, 2014 ), 相关机制尚不十分清楚.白雪等(2014)发现, 尽管羊草草原主要受N素限制, 但在一定条件下也受P素限制.因此, 关于P添加对羊草植物功能性状的影响近年来逐渐受到关注.例如, 白雪等(2014)研究发现, P添加提高了羊草的叶片N和P含量; 黄菊莹等(2012)的研究表明随着P添加梯度增加, 羊草的根冠比降低.而 且, N供应水平的变化也影响了羊草对P的吸收 (Marklein & Houlton, 2012 ), 因此, N、P供应比例的改变可能会对植物功能性状产生较大的影响.通过控制实验, 开展不同N添加水平下植物对P添加梯度的响应与适应机制的研究, 有助于更好地理解植物对养分环境波动的适应能力. ...
... 以往关于羊草对养分添加的实验研究多是在野外的自然生境中进行的(Chen et al ., 2005 ; 万宏伟等, 2008 ; Lan & Bai, 2012 ; Lü et al ., 2013 ; 白雪等, 2014 ), 或是通过盆栽实验, 但只针对某一方面的生理生态特性进行研究(王云龙等, 2004 ; Xu & Zhou, 2006 ).相比以往研究, 本研究通过盆栽实验, 利用温室控制稳定的温度和湿度, 添加定量的有效态N和P, 排除了气候变化、环境异质性和群落内物种竞争等干扰因素.本实验设计了低、中、高3个N和P梯度及其交互作用, 以更好地模拟养分供应的不同比例, 较为系统地测定了羊草的地上、地下关键功能性状, 以期更好地揭示羊草对不同养分环境的响应及适应机制. ...
... 我们的结果表明, 羊草的地上生物量主要受N添加的影响, 高N水平下, 羊草的地上生物量约为低N水平的3.5倍, 仅在低N水平下, P添加会提高羊草的地上生物量, 说明在N供应水平较低的情况下, P添加对羊草生长有一定的促进作用.羊草的总生物量也主要受N添加的影响, 中N和高N水平羊草的总生物量约为低N水平的2.0-3.0倍.这些结果表明, 羊草的个体生长主要受N素限制, 这与基于野外养分添加实验的研究结果较为一致, 例如: 白雪等(2014) 研究发现N添加对羊草生长具有明显的促进效应, 使其个体生物量显著增加; 潘庆民等(2005) 研究表明N添加显著提高了羊草群落的地上生物量.与地上生物量相反, 羊草的地下生物量主要受P添加的影响, 尤其在中N和高N水平, P添加会显著降低羊草的地下生物量.羊草的根冠比受N、P添加的共同影响, 随着N和P添加的梯度, 根冠比显著降低, 表明N、P添加均促进了植物向地上生物量的分配.此结果与黄菊莹等(2012)通过盆栽实验研究羊草对N、P添加的响应结果较为一致.通过分析N、P在叶片与根系生物量之间的分配, 我们的研究发现N、P添加均显著促进了羊草向叶片生物量的N、P分配, 在高N水平, N、P向叶片生物量的分配比例比低N水平分别高出4.2倍和2.8倍.而且, 羊草的叶片N含量显著高于根系N含量, N、P添加提高了叶片P含量, 但降低了根系P含量, 也表明N、P添加促进了羊草向叶片生物量的N、P分配.Müller等(2000)也认为在养分条件较好时, 植物倾向于将生物量较多地分配于地上部分, 在养分条件较差时则倾向于分配至地下部分. ...
Tradeoffs and thresholds in the effects of nitrogen addition on biodiversity and ecosystem functioning: Evidence from Inner Mongolia grasslands.
2
2010
... 和N一样, P也是植物生长的主要养分限制因子, 因此N素和P素添加均被用于恢复退化的草地生态系统, 以恢复生态系统的生产力.目前, 关于羊草功能性状对养分添加响应的研究多集中在N素添加(Chen et al ., 2005 ; 万宏伟等, 2008 ; Bai et al ., 2010 ; Lan & Bai, 2012 ; Lü et al ., 2013 ), 而关于P添加以及N和P交互作用对羊草功能性状的影响研究得较少(黄菊莹等, 2012 ; 白雪等, 2014 ), 相关机制尚不十分清楚.白雪等(2014)发现, 尽管羊草草原主要受N素限制, 但在一定条件下也受P素限制.因此, 关于P添加对羊草植物功能性状的影响近年来逐渐受到关注.例如, 白雪等(2014)研究发现, P添加提高了羊草的叶片N和P含量; 黄菊莹等(2012)的研究表明随着P添加梯度增加, 羊草的根冠比降低.而 且, N供应水平的变化也影响了羊草对P的吸收 (Marklein & Houlton, 2012 ), 因此, N、P供应比例的改变可能会对植物功能性状产生较大的影响.通过控制实验, 开展不同N添加水平下植物对P添加梯度的响应与适应机制的研究, 有助于更好地理解植物对养分环境波动的适应能力. ...
... 实验设计包括2个养分(N、P)添加处理, 每个养分设置3个水平, 其中N添加的3个浓度水平为: N1 = 50 mg·kg-1 、N2 = 100 mg·kg-1 、N3 = 250 mg·kg-1 , P添加的3个浓度水平为: P1 = 5 mg·kg-1 、P2 = 10 mg·kg-1 、P3 = 25 mg·kg-1 , 添加量均为纯N或纯P的质量与花盆内蛭石质量之比.本实验共设计10个处理, 每个处理均包含不同的N和P添加梯度, 具体为: N0P0 (对照)、N1P1、N1P2、N1P3、N2P1、N2P2、N2P3、N3P1、N3P2、N3P3, 每个处理10个重复.N和P添加的浓度水平是参考中国科学院内蒙古草原生态系统定位研究站自2000年设置的长期N素(0、1.75、5.25、10.5、17.5、28.0 g N· m-2 )和P素(0、2、4、8、16、32 g P2 O5 ·m-2 )添加实验平台(Bai et al ., 2010 )的实验处理设置的.由于野外实验是按施肥面积换算的, 与室内实验按盆栽土壤质量换算不同, 故而根据野外实验的养分处理水平, 本实验将N添加量设计为50、100、250 mg N·kg-1 , 而P添加量与N的比例按1:10计算, 设计为5、10、25 mg P·kg-1 .N、P养分的添加采用配制并稀释好的NH4 NO3 和Na2 HPO4 溶液, 同时在对照和所有处理中均添加了由ZnSO4 、MnCl2 、Na2 MoO4 、H3 BO3 配置的微量元素混合溶液, 以保证植物不受其他元素的限制.2010年5月初, 待羊草幼苗完全成活后, 根据N、P添加处理, 分6次每隔10天加入Na2 HPO4 和NH4 NO3 营养液. ...
Comparing physiological responses of two dominant grass species to nitrogen addition in Xilin River Basin of China.
2
2005
... 和N一样, P也是植物生长的主要养分限制因子, 因此N素和P素添加均被用于恢复退化的草地生态系统, 以恢复生态系统的生产力.目前, 关于羊草功能性状对养分添加响应的研究多集中在N素添加(Chen et al ., 2005 ; 万宏伟等, 2008 ; Bai et al ., 2010 ; Lan & Bai, 2012 ; Lü et al ., 2013 ), 而关于P添加以及N和P交互作用对羊草功能性状的影响研究得较少(黄菊莹等, 2012 ; 白雪等, 2014 ), 相关机制尚不十分清楚.白雪等(2014)发现, 尽管羊草草原主要受N素限制, 但在一定条件下也受P素限制.因此, 关于P添加对羊草植物功能性状的影响近年来逐渐受到关注.例如, 白雪等(2014)研究发现, P添加提高了羊草的叶片N和P含量; 黄菊莹等(2012)的研究表明随着P添加梯度增加, 羊草的根冠比降低.而 且, N供应水平的变化也影响了羊草对P的吸收 (Marklein & Houlton, 2012 ), 因此, N、P供应比例的改变可能会对植物功能性状产生较大的影响.通过控制实验, 开展不同N添加水平下植物对P添加梯度的响应与适应机制的研究, 有助于更好地理解植物对养分环境波动的适应能力. ...
... 以往关于羊草对养分添加的实验研究多是在野外的自然生境中进行的(Chen et al ., 2005 ; 万宏伟等, 2008 ; Lan & Bai, 2012 ; Lü et al ., 2013 ; 白雪等, 2014 ), 或是通过盆栽实验, 但只针对某一方面的生理生态特性进行研究(王云龙等, 2004 ; Xu & Zhou, 2006 ).相比以往研究, 本研究通过盆栽实验, 利用温室控制稳定的温度和湿度, 添加定量的有效态N和P, 排除了气候变化、环境异质性和群落内物种竞争等干扰因素.本实验设计了低、中、高3个N和P梯度及其交互作用, 以更好地模拟养分供应的不同比例, 较为系统地测定了羊草的地上、地下关键功能性状, 以期更好地揭示羊草对不同养分环境的响应及适应机制. ...
A handbook of protocols for standardised and easy measurement of plant functional traits worldwide.
1
2003
... 羊草N、P向叶片的分配比例增加, 主要是因为随着N、P添加, 羊草由对地下养分的竞争逐渐转化为对地上光资源的竞争(Pan et al ., 2011 ; Lan & Bai, 2012 ).这不仅是羊草对养分环境波动的适应, 也有利于其在自然群落中的竞争.因为随着N和P添加, 根系的养分吸收能力逐渐过剩, 将更多的资源分配给地上部分, 植株变得高大, 以利于获得更多的光照(Lan & Bai, 2012 ).SLA 和SRL 反映了植物对光强和土壤养分的获取能力(Cornelissen et al ., 2003 ).本研究中, 羊草SRL 在中N水平最低, 而在低N和高N水平较高.其原因可能是, 在中N水平, 羊草对养分资源的吸收高于低N水平, 因此羊草降低SRL 以适应较高浓度的养分环境.随着N添加, 高N水平促进了植株的养分周转(Marklein & Houlton, 2012 ), 细根比例增加以满足植物快速生长的养分需求, 因此羊草SRL 又随之增加.本研究中, 羊草的SLA 较为稳定, 在低N、P水平, 植物分配较多的资源于叶片以提高其最大光合潜能, 而随着N、P添加, 羊草生长不受养分限制, 其增加N、P分配也不能提高光合速率, 因而SLA 较为稳定.万宏伟等(2008)认为, 随着N添加导致光资源竞争加剧, 不同物种对光资源的竞争策略和竞争力有显著差异, 而羊草能够通过提高SLA 和叶片N含量提高其对光资源的利用. ...
Nutritional constraints in terrestrial and freshwater food webs.
1
2000
... 羊草在对养分添加做出响应的同时, 虽然其生物量和生理性状有显著响应, 但也具有保持生物计量化学稳定的特性, 即相对于变化的外界养分供应而言, 植物在一定范围内具有保持自身N:P稳定的能力(Elser et al ., 2000 ; Zhang et al ., 2003 ).本实验结果也表明, 尽管羊草组织(叶片和根系)的N或P含量对养分添加有着较明显的响应, 但羊草的叶片N:P始终保持在12-15之间, 而在较高的N和P添加水平, 羊草的N:P基本维持在14-15左右, 与传统的养分限制理论中以N:P为14或16作为区分N或P限制的阈值较为相符(Koerselman & Meuleman, 1996 ).我们的研究还发现在盆栽实验中, N和P的作用在一定程度上是互补的.一般认为叶片N含量是直接与植物光合能力相关的指标, 本实验中高N处理下羊草叶片的N含量显著高于其他处理, 但从光合速率的数据看, 高N下叶片光合速率并没有随之升高, 而是随着P添加的增加而显著上升, 说明在本实验中, P可能是羊草光合作用的重要限制因子.早期的一些研究发现部分植物的光合作用是受到P限制的(Terry & Ulrich, 1973 ; Lapointe, 1987 ), 而Reich等(2009)通过对多个生态系统的整合分析, 发现整体来看叶片N和P含量均与其最大光合速率显著相关(p < 0.0001), 但全因子的回归模型显示N是主因子(p < 0.0001, R 2 = 0.52), 而N和P有着显著的交互 作用. ...
Plant coexistence mediated by arbuscular mycorrhizal fungi.
1
2003
... 我们的研究表明, 相对于地上性状, P添加对羊草的地下性状影响更大, 其原因可能是, 羊草是根系与丛枝菌根真菌(AMF)共生的物种, 而菌根真菌更有利于根系对P的吸收(Li & Feng, 2001 ).已有研究表明, 不同植物的共生菌根效应存在很大差异, 可以是正效应、中性或负效应, 与植物生长的养分环境有关.在土壤有效养分供应充足的情况下, 菌根共生对植物生长没有积极影响, 甚至会导致植物生物量下降(Hart et al ., 2003 ; 雷垚等, 2013 ).本研究中, 在中、高N 水平, P 添加显著降低了羊草的根系P 含量和地下生物量, 其原因可能是在N供应较高条件下, 菌根真菌对P吸收的作用有限, 而P的过量添加抑制了根系生长.植物功能性状之间的权衡(tradeoffs)或协同(synergies)关系, 反映了植物为适应环境变化所采取的策略(Lavorel & Grigulis, 2012 ).本研究中, 尽管羊草的地上生物量与地下生物量之间没有显著的相关性, 但从总的趋势看, 沿着N、P添加梯度, 羊草的地上生物量增加, 而地下生物量降低, 根冠比也呈降低趋势, 表明羊草在地上与地下部分的资源分配方面采取了一定的权衡策略.羊草的叶片N与根系N含量、叶片P与根系P含量之间均呈显著的正相关关系, 其原因主要是根系从土壤中吸收N、P进而传输到叶片, 因而叶片与根系养分表现出高度的协同性.羊草的SLA 与SRL 之间呈较弱的正相关关系, 表明羊草叶片与根系在资源获取和利用方面具有相对的独立性. ...
羊草生物量和养分分配对养分和水分添加的响应
2
2012
... 和N一样, P也是植物生长的主要养分限制因子, 因此N素和P素添加均被用于恢复退化的草地生态系统, 以恢复生态系统的生产力.目前, 关于羊草功能性状对养分添加响应的研究多集中在N素添加(Chen et al ., 2005 ; 万宏伟等, 2008 ; Bai et al ., 2010 ; Lan & Bai, 2012 ; Lü et al ., 2013 ), 而关于P添加以及N和P交互作用对羊草功能性状的影响研究得较少(黄菊莹等, 2012 ; 白雪等, 2014 ), 相关机制尚不十分清楚.白雪等(2014)发现, 尽管羊草草原主要受N素限制, 但在一定条件下也受P素限制.因此, 关于P添加对羊草植物功能性状的影响近年来逐渐受到关注.例如, 白雪等(2014)研究发现, P添加提高了羊草的叶片N和P含量; 黄菊莹等(2012)的研究表明随着P添加梯度增加, 羊草的根冠比降低.而 且, N供应水平的变化也影响了羊草对P的吸收 (Marklein & Houlton, 2012 ), 因此, N、P供应比例的改变可能会对植物功能性状产生较大的影响.通过控制实验, 开展不同N添加水平下植物对P添加梯度的响应与适应机制的研究, 有助于更好地理解植物对养分环境波动的适应能力. ...
... 目前, 已有的养分添加实验研究主要针对羊草地上部分的功能性状, 很少涉及羊草地下部分(如根系)的功能性状, 尤其是关于羊草的地上-地下功能性状及其关联的研究较少.Liu等(2010)的研究表明在群落、局地、区域和样带尺度上, 包括羊草在内的许多草原植物的地上和地下功能性状之间具有一定的联系, 如叶片N与根系N含量、SLA 与比根长(SRL )之间均呈显著的正相关关系.而且, 黄菊莹等(2012) 研究发现, 随着N和P添加量的增加, 羊草的地上、地下生物量和养分库呈现先增加后降低的趋势, 根冠比呈降低的趋势.因此, 养分添加可能会改变羊草的地上-地下功能性状及其关联, 但缺乏相关的研究来进行验证.开展关于羊草的地上-地下功能性状对N、P添加的响应及关联研究, 有助于全面理解和揭示羊草对养分添加的响应与适应机制, 为退化草地生态系统的恢复提供理论依据. ...
羊草生物量和养分分配对养分和水分添加的响应
2
2012
... 和N一样, P也是植物生长的主要养分限制因子, 因此N素和P素添加均被用于恢复退化的草地生态系统, 以恢复生态系统的生产力.目前, 关于羊草功能性状对养分添加响应的研究多集中在N素添加(Chen et al ., 2005 ; 万宏伟等, 2008 ; Bai et al ., 2010 ; Lan & Bai, 2012 ; Lü et al ., 2013 ), 而关于P添加以及N和P交互作用对羊草功能性状的影响研究得较少(黄菊莹等, 2012 ; 白雪等, 2014 ), 相关机制尚不十分清楚.白雪等(2014)发现, 尽管羊草草原主要受N素限制, 但在一定条件下也受P素限制.因此, 关于P添加对羊草植物功能性状的影响近年来逐渐受到关注.例如, 白雪等(2014)研究发现, P添加提高了羊草的叶片N和P含量; 黄菊莹等(2012)的研究表明随着P添加梯度增加, 羊草的根冠比降低.而 且, N供应水平的变化也影响了羊草对P的吸收 (Marklein & Houlton, 2012 ), 因此, N、P供应比例的改变可能会对植物功能性状产生较大的影响.通过控制实验, 开展不同N添加水平下植物对P添加梯度的响应与适应机制的研究, 有助于更好地理解植物对养分环境波动的适应能力. ...
... 目前, 已有的养分添加实验研究主要针对羊草地上部分的功能性状, 很少涉及羊草地下部分(如根系)的功能性状, 尤其是关于羊草的地上-地下功能性状及其关联的研究较少.Liu等(2010)的研究表明在群落、局地、区域和样带尺度上, 包括羊草在内的许多草原植物的地上和地下功能性状之间具有一定的联系, 如叶片N与根系N含量、SLA 与比根长(SRL )之间均呈显著的正相关关系.而且, 黄菊莹等(2012) 研究发现, 随着N和P添加量的增加, 羊草的地上、地下生物量和养分库呈现先增加后降低的趋势, 根冠比呈降低的趋势.因此, 养分添加可能会改变羊草的地上-地下功能性状及其关联, 但缺乏相关的研究来进行验证.开展关于羊草的地上-地下功能性状对N、P添加的响应及关联研究, 有助于全面理解和揭示羊草对养分添加的响应与适应机制, 为退化草地生态系统的恢复提供理论依据. ...
The vegetation N:P ratio: A new tool to detect the nature of nutrient limitation.
1
1996
... 羊草在对养分添加做出响应的同时, 虽然其生物量和生理性状有显著响应, 但也具有保持生物计量化学稳定的特性, 即相对于变化的外界养分供应而言, 植物在一定范围内具有保持自身N:P稳定的能力(Elser et al ., 2000 ; Zhang et al ., 2003 ).本实验结果也表明, 尽管羊草组织(叶片和根系)的N或P含量对养分添加有着较明显的响应, 但羊草的叶片N:P始终保持在12-15之间, 而在较高的N和P添加水平, 羊草的N:P基本维持在14-15左右, 与传统的养分限制理论中以N:P为14或16作为区分N或P限制的阈值较为相符(Koerselman & Meuleman, 1996 ).我们的研究还发现在盆栽实验中, N和P的作用在一定程度上是互补的.一般认为叶片N含量是直接与植物光合能力相关的指标, 本实验中高N处理下羊草叶片的N含量显著高于其他处理, 但从光合速率的数据看, 高N下叶片光合速率并没有随之升高, 而是随着P添加的增加而显著上升, 说明在本实验中, P可能是羊草光合作用的重要限制因子.早期的一些研究发现部分植物的光合作用是受到P限制的(Terry & Ulrich, 1973 ; Lapointe, 1987 ), 而Reich等(2009)通过对多个生态系统的整合分析, 发现整体来看叶片N和P含量均与其最大光合速率显著相关(p < 0.0001), 但全因子的回归模型显示N是主因子(p < 0.0001, R 2 = 0.52), 而N和P有着显著的交互 作用. ...
Testing mechanisms of N-enrichment- induced species loss in a semiarid Inner Mongolia grassland: Critical thresholds and implications for long-term ecosystem responses.
4
2012
... 和N一样, P也是植物生长的主要养分限制因子, 因此N素和P素添加均被用于恢复退化的草地生态系统, 以恢复生态系统的生产力.目前, 关于羊草功能性状对养分添加响应的研究多集中在N素添加(Chen et al ., 2005 ; 万宏伟等, 2008 ; Bai et al ., 2010 ; Lan & Bai, 2012 ; Lü et al ., 2013 ), 而关于P添加以及N和P交互作用对羊草功能性状的影响研究得较少(黄菊莹等, 2012 ; 白雪等, 2014 ), 相关机制尚不十分清楚.白雪等(2014)发现, 尽管羊草草原主要受N素限制, 但在一定条件下也受P素限制.因此, 关于P添加对羊草植物功能性状的影响近年来逐渐受到关注.例如, 白雪等(2014)研究发现, P添加提高了羊草的叶片N和P含量; 黄菊莹等(2012)的研究表明随着P添加梯度增加, 羊草的根冠比降低.而 且, N供应水平的变化也影响了羊草对P的吸收 (Marklein & Houlton, 2012 ), 因此, N、P供应比例的改变可能会对植物功能性状产生较大的影响.通过控制实验, 开展不同N添加水平下植物对P添加梯度的响应与适应机制的研究, 有助于更好地理解植物对养分环境波动的适应能力. ...
... 以往关于羊草对养分添加的实验研究多是在野外的自然生境中进行的(Chen et al ., 2005 ; 万宏伟等, 2008 ; Lan & Bai, 2012 ; Lü et al ., 2013 ; 白雪等, 2014 ), 或是通过盆栽实验, 但只针对某一方面的生理生态特性进行研究(王云龙等, 2004 ; Xu & Zhou, 2006 ).相比以往研究, 本研究通过盆栽实验, 利用温室控制稳定的温度和湿度, 添加定量的有效态N和P, 排除了气候变化、环境异质性和群落内物种竞争等干扰因素.本实验设计了低、中、高3个N和P梯度及其交互作用, 以更好地模拟养分供应的不同比例, 较为系统地测定了羊草的地上、地下关键功能性状, 以期更好地揭示羊草对不同养分环境的响应及适应机制. ...
... 羊草N、P向叶片的分配比例增加, 主要是因为随着N、P添加, 羊草由对地下养分的竞争逐渐转化为对地上光资源的竞争(Pan et al ., 2011 ; Lan & Bai, 2012 ).这不仅是羊草对养分环境波动的适应, 也有利于其在自然群落中的竞争.因为随着N和P添加, 根系的养分吸收能力逐渐过剩, 将更多的资源分配给地上部分, 植株变得高大, 以利于获得更多的光照(Lan & Bai, 2012 ).SLA 和SRL 反映了植物对光强和土壤养分的获取能力(Cornelissen et al ., 2003 ).本研究中, 羊草SRL 在中N水平最低, 而在低N和高N水平较高.其原因可能是, 在中N水平, 羊草对养分资源的吸收高于低N水平, 因此羊草降低SRL 以适应较高浓度的养分环境.随着N添加, 高N水平促进了植株的养分周转(Marklein & Houlton, 2012 ), 细根比例增加以满足植物快速生长的养分需求, 因此羊草SRL 又随之增加.本研究中, 羊草的SLA 较为稳定, 在低N、P水平, 植物分配较多的资源于叶片以提高其最大光合潜能, 而随着N、P添加, 羊草生长不受养分限制, 其增加N、P分配也不能提高光合速率, 因而SLA 较为稳定.万宏伟等(2008)认为, 随着N添加导致光资源竞争加剧, 不同物种对光资源的竞争策略和竞争力有显著差异, 而羊草能够通过提高SLA 和叶片N含量提高其对光资源的利用. ...
... ).这不仅是羊草对养分环境波动的适应, 也有利于其在自然群落中的竞争.因为随着N和P添加, 根系的养分吸收能力逐渐过剩, 将更多的资源分配给地上部分, 植株变得高大, 以利于获得更多的光照(Lan & Bai, 2012 ).SLA 和SRL 反映了植物对光强和土壤养分的获取能力(Cornelissen et al ., 2003 ).本研究中, 羊草SRL 在中N水平最低, 而在低N和高N水平较高.其原因可能是, 在中N水平, 羊草对养分资源的吸收高于低N水平, 因此羊草降低SRL 以适应较高浓度的养分环境.随着N添加, 高N水平促进了植株的养分周转(Marklein & Houlton, 2012 ), 细根比例增加以满足植物快速生长的养分需求, 因此羊草SRL 又随之增加.本研究中, 羊草的SLA 较为稳定, 在低N、P水平, 植物分配较多的资源于叶片以提高其最大光合潜能, 而随着N、P添加, 羊草生长不受养分限制, 其增加N、P分配也不能提高光合速率, 因而SLA 较为稳定.万宏伟等(2008)认为, 随着N添加导致光资源竞争加剧, 不同物种对光资源的竞争策略和竞争力有显著差异, 而羊草能够通过提高SLA 和叶片N含量提高其对光资源的利用. ...
Phosphorus-and nitrogen-limited photosynthesis and growth of Gracilaria tikvahiae (Rhodophyceae) in the Florida Keys: An experimental field study.
1
1987
... 羊草在对养分添加做出响应的同时, 虽然其生物量和生理性状有显著响应, 但也具有保持生物计量化学稳定的特性, 即相对于变化的外界养分供应而言, 植物在一定范围内具有保持自身N:P稳定的能力(Elser et al ., 2000 ; Zhang et al ., 2003 ).本实验结果也表明, 尽管羊草组织(叶片和根系)的N或P含量对养分添加有着较明显的响应, 但羊草的叶片N:P始终保持在12-15之间, 而在较高的N和P添加水平, 羊草的N:P基本维持在14-15左右, 与传统的养分限制理论中以N:P为14或16作为区分N或P限制的阈值较为相符(Koerselman & Meuleman, 1996 ).我们的研究还发现在盆栽实验中, N和P的作用在一定程度上是互补的.一般认为叶片N含量是直接与植物光合能力相关的指标, 本实验中高N处理下羊草叶片的N含量显著高于其他处理, 但从光合速率的数据看, 高N下叶片光合速率并没有随之升高, 而是随着P添加的增加而显著上升, 说明在本实验中, P可能是羊草光合作用的重要限制因子.早期的一些研究发现部分植物的光合作用是受到P限制的(Terry & Ulrich, 1973 ; Lapointe, 1987 ), 而Reich等(2009)通过对多个生态系统的整合分析, 发现整体来看叶片N和P含量均与其最大光合速率显著相关(p < 0.0001), 但全因子的回归模型显示N是主因子(p < 0.0001, R 2 = 0.52), 而N和P有着显著的交互 作用. ...
How fundamental plant functional trait relationships scale-up to trade-offs and synergies in ecosystem services.
1
2012
... 我们的研究表明, 相对于地上性状, P添加对羊草的地下性状影响更大, 其原因可能是, 羊草是根系与丛枝菌根真菌(AMF)共生的物种, 而菌根真菌更有利于根系对P的吸收(Li & Feng, 2001 ).已有研究表明, 不同植物的共生菌根效应存在很大差异, 可以是正效应、中性或负效应, 与植物生长的养分环境有关.在土壤有效养分供应充足的情况下, 菌根共生对植物生长没有积极影响, 甚至会导致植物生物量下降(Hart et al ., 2003 ; 雷垚等, 2013 ).本研究中, 在中、高N 水平, P 添加显著降低了羊草的根系P 含量和地下生物量, 其原因可能是在N供应较高条件下, 菌根真菌对P吸收的作用有限, 而P的过量添加抑制了根系生长.植物功能性状之间的权衡(tradeoffs)或协同(synergies)关系, 反映了植物为适应环境变化所采取的策略(Lavorel & Grigulis, 2012 ).本研究中, 尽管羊草的地上生物量与地下生物量之间没有显著的相关性, 但从总的趋势看, 沿着N、P添加梯度, 羊草的地上生物量增加, 而地下生物量降低, 根冠比也呈降低趋势, 表明羊草在地上与地下部分的资源分配方面采取了一定的权衡策略.羊草的叶片N与根系N含量、叶片P与根系P含量之间均呈显著的正相关关系, 其原因主要是根系从土壤中吸收N、P进而传输到叶片, 因而叶片与根系养分表现出高度的协同性.羊草的SLA 与SRL 之间呈较弱的正相关关系, 表明羊草叶片与根系在资源获取和利用方面具有相对的独立性. ...
土著菌根真菌和混生植物对羊草生长和磷营养的影响
1
2013
... 我们的研究表明, 相对于地上性状, P添加对羊草的地下性状影响更大, 其原因可能是, 羊草是根系与丛枝菌根真菌(AMF)共生的物种, 而菌根真菌更有利于根系对P的吸收(Li & Feng, 2001 ).已有研究表明, 不同植物的共生菌根效应存在很大差异, 可以是正效应、中性或负效应, 与植物生长的养分环境有关.在土壤有效养分供应充足的情况下, 菌根共生对植物生长没有积极影响, 甚至会导致植物生物量下降(Hart et al ., 2003 ; 雷垚等, 2013 ).本研究中, 在中、高N 水平, P 添加显著降低了羊草的根系P 含量和地下生物量, 其原因可能是在N供应较高条件下, 菌根真菌对P吸收的作用有限, 而P的过量添加抑制了根系生长.植物功能性状之间的权衡(tradeoffs)或协同(synergies)关系, 反映了植物为适应环境变化所采取的策略(Lavorel & Grigulis, 2012 ).本研究中, 尽管羊草的地上生物量与地下生物量之间没有显著的相关性, 但从总的趋势看, 沿着N、P添加梯度, 羊草的地上生物量增加, 而地下生物量降低, 根冠比也呈降低趋势, 表明羊草在地上与地下部分的资源分配方面采取了一定的权衡策略.羊草的叶片N与根系N含量、叶片P与根系P含量之间均呈显著的正相关关系, 其原因主要是根系从土壤中吸收N、P进而传输到叶片, 因而叶片与根系养分表现出高度的协同性.羊草的SLA 与SRL 之间呈较弱的正相关关系, 表明羊草叶片与根系在资源获取和利用方面具有相对的独立性. ...
土著菌根真菌和混生植物对羊草生长和磷营养的影响
1
2013
... 我们的研究表明, 相对于地上性状, P添加对羊草的地下性状影响更大, 其原因可能是, 羊草是根系与丛枝菌根真菌(AMF)共生的物种, 而菌根真菌更有利于根系对P的吸收(Li & Feng, 2001 ).已有研究表明, 不同植物的共生菌根效应存在很大差异, 可以是正效应、中性或负效应, 与植物生长的养分环境有关.在土壤有效养分供应充足的情况下, 菌根共生对植物生长没有积极影响, 甚至会导致植物生物量下降(Hart et al ., 2003 ; 雷垚等, 2013 ).本研究中, 在中、高N 水平, P 添加显著降低了羊草的根系P 含量和地下生物量, 其原因可能是在N供应较高条件下, 菌根真菌对P吸收的作用有限, 而P的过量添加抑制了根系生长.植物功能性状之间的权衡(tradeoffs)或协同(synergies)关系, 反映了植物为适应环境变化所采取的策略(Lavorel & Grigulis, 2012 ).本研究中, 尽管羊草的地上生物量与地下生物量之间没有显著的相关性, 但从总的趋势看, 沿着N、P添加梯度, 羊草的地上生物量增加, 而地下生物量降低, 根冠比也呈降低趋势, 表明羊草在地上与地下部分的资源分配方面采取了一定的权衡策略.羊草的叶片N与根系N含量、叶片P与根系P含量之间均呈显著的正相关关系, 其原因主要是根系从土壤中吸收N、P进而传输到叶片, 因而叶片与根系养分表现出高度的协同性.羊草的SLA 与SRL 之间呈较弱的正相关关系, 表明羊草叶片与根系在资源获取和利用方面具有相对的独立性. ...
放牧影响下羊草草原和大针茅草原植物多样性的变化
1
1993
... 羊草(Leymus chinensis )是多年生根茎禾草, 由于其营养繁殖能力很强, 且具有典型的克隆生长特性, 是我国北方典型草原的主要建群种或优势种, 在东北草原和内蒙古草原经常形成大面积的单优种植被(李永宏, 1993 ).自1980年以来, 由于长期的过度放牧, 我国北方草原生态系统的结构和功能严重退化, 羊草种群也受到了明显的影响, 其生物量和密度显著降低(王仁忠, 1997 ; 王玉辉等, 2002 ).养分添加(主要是N素添加)是恢复退化草地生态系统的一种有效手段, 但目前在草地的恢复与治理上应用较少(潘庆民等, 2005 ).因此, 研究羊草对养分添加的响应与适应机制, 对于我国草地生态系统的恢复与管理具有重要意义. ...
放牧影响下羊草草原和大针茅草原植物多样性的变化
1
1993
... 羊草(Leymus chinensis )是多年生根茎禾草, 由于其营养繁殖能力很强, 且具有典型的克隆生长特性, 是我国北方典型草原的主要建群种或优势种, 在东北草原和内蒙古草原经常形成大面积的单优种植被(李永宏, 1993 ).自1980年以来, 由于长期的过度放牧, 我国北方草原生态系统的结构和功能严重退化, 羊草种群也受到了明显的影响, 其生物量和密度显著降低(王仁忠, 1997 ; 王玉辉等, 2002 ).养分添加(主要是N素添加)是恢复退化草地生态系统的一种有效手段, 但目前在草地的恢复与治理上应用较少(潘庆民等, 2005 ).因此, 研究羊草对养分添加的响应与适应机制, 对于我国草地生态系统的恢复与管理具有重要意义. ...
Coordinated variation in leaf and root traits across multiple spatial scales in Chinese semi-arid and arid ecosystems.
2010
Convergent responses of nitrogen and phosphorus resorption to nitrogen inputs in a semiarid grassland.
3
2013
... 关于羊草的功能性状对N素添加的响应及其适应策略, 已经开展了较多的研究, 但在不同组织水平下, 研究结果也不尽相同.例如, 在生态计量化学方面, 通过在内蒙古典型草原进行的养分添加实验研究发现: N添加提高了羊草的叶片N含量, 但对叶片P含量没有显著影响(白雪等, 2014 ).N添加也能显著提高羊草绿叶和衰老叶片的N、P含量, 从而降低叶片对N和P的再吸收, 整体上提高N和P在植物体内的周转速率(Lü et al ., 2013 ).根据生长速率假说(growth rate hypothesis), 羊草的生长速率与全P含量存在正相关关系, 而与N:P存在负相关关系, 不同来源的羊草种植在同一环境条件下, 来自N、P含量较高土壤的羊草具有较高的生长速率, 这可能是羊草对特定地域生境条件长期适应的结果(徐劲草和许新宜, 2013 ).也有研究发现, 羊草植株的N:P随着N添加在一定范围内保持稳定(Zhang et al ., 2004 ).从生理特性方面, Chen等(2005)研究发现, N添加能够提高羊草的最大光合速率, 但对羊草的净光合速率、蒸腾速率和气孔导度没有显著影响; 随着N添加梯度加大, 羊草的水分利用效率增加, 而N素利用效率降低.万宏伟等(2008)研究发现羊草通过增加比叶面积(SLA )和叶片N含量提高对光的竞争能力.白雪等(2014)研究发现, 羊草对N添加的响应因组织水平而异, 也受年际间降水变化的影响, 羊草通过增加SLA、 叶片大小和叶片N含量, 提高整体光合能力, 从而促进个体生长.这些结果主要是定性描述羊草对N变化的生理生态响应, 并没有在机理上对这些响应做出解释. ...
... 和N一样, P也是植物生长的主要养分限制因子, 因此N素和P素添加均被用于恢复退化的草地生态系统, 以恢复生态系统的生产力.目前, 关于羊草功能性状对养分添加响应的研究多集中在N素添加(Chen et al ., 2005 ; 万宏伟等, 2008 ; Bai et al ., 2010 ; Lan & Bai, 2012 ; Lü et al ., 2013 ), 而关于P添加以及N和P交互作用对羊草功能性状的影响研究得较少(黄菊莹等, 2012 ; 白雪等, 2014 ), 相关机制尚不十分清楚.白雪等(2014)发现, 尽管羊草草原主要受N素限制, 但在一定条件下也受P素限制.因此, 关于P添加对羊草植物功能性状的影响近年来逐渐受到关注.例如, 白雪等(2014)研究发现, P添加提高了羊草的叶片N和P含量; 黄菊莹等(2012)的研究表明随着P添加梯度增加, 羊草的根冠比降低.而 且, N供应水平的变化也影响了羊草对P的吸收 (Marklein & Houlton, 2012 ), 因此, N、P供应比例的改变可能会对植物功能性状产生较大的影响.通过控制实验, 开展不同N添加水平下植物对P添加梯度的响应与适应机制的研究, 有助于更好地理解植物对养分环境波动的适应能力. ...
... 以往关于羊草对养分添加的实验研究多是在野外的自然生境中进行的(Chen et al ., 2005 ; 万宏伟等, 2008 ; Lan & Bai, 2012 ; Lü et al ., 2013 ; 白雪等, 2014 ), 或是通过盆栽实验, 但只针对某一方面的生理生态特性进行研究(王云龙等, 2004 ; Xu & Zhou, 2006 ).相比以往研究, 本研究通过盆栽实验, 利用温室控制稳定的温度和湿度, 添加定量的有效态N和P, 排除了气候变化、环境异质性和群落内物种竞争等干扰因素.本实验设计了低、中、高3个N和P梯度及其交互作用, 以更好地模拟养分供应的不同比例, 较为系统地测定了羊草的地上、地下关键功能性状, 以期更好地揭示羊草对不同养分环境的响应及适应机制. ...
Nitrogen inputs accelerate phosphorus cycling rates across a wide variety of terrestrial ecosystems.
2
2012
... 和N一样, P也是植物生长的主要养分限制因子, 因此N素和P素添加均被用于恢复退化的草地生态系统, 以恢复生态系统的生产力.目前, 关于羊草功能性状对养分添加响应的研究多集中在N素添加(Chen et al ., 2005 ; 万宏伟等, 2008 ; Bai et al ., 2010 ; Lan & Bai, 2012 ; Lü et al ., 2013 ), 而关于P添加以及N和P交互作用对羊草功能性状的影响研究得较少(黄菊莹等, 2012 ; 白雪等, 2014 ), 相关机制尚不十分清楚.白雪等(2014)发现, 尽管羊草草原主要受N素限制, 但在一定条件下也受P素限制.因此, 关于P添加对羊草植物功能性状的影响近年来逐渐受到关注.例如, 白雪等(2014)研究发现, P添加提高了羊草的叶片N和P含量; 黄菊莹等(2012)的研究表明随着P添加梯度增加, 羊草的根冠比降低.而 且, N供应水平的变化也影响了羊草对P的吸收 (Marklein & Houlton, 2012 ), 因此, N、P供应比例的改变可能会对植物功能性状产生较大的影响.通过控制实验, 开展不同N添加水平下植物对P添加梯度的响应与适应机制的研究, 有助于更好地理解植物对养分环境波动的适应能力. ...
... 羊草N、P向叶片的分配比例增加, 主要是因为随着N、P添加, 羊草由对地下养分的竞争逐渐转化为对地上光资源的竞争(Pan et al ., 2011 ; Lan & Bai, 2012 ).这不仅是羊草对养分环境波动的适应, 也有利于其在自然群落中的竞争.因为随着N和P添加, 根系的养分吸收能力逐渐过剩, 将更多的资源分配给地上部分, 植株变得高大, 以利于获得更多的光照(Lan & Bai, 2012 ).SLA 和SRL 反映了植物对光强和土壤养分的获取能力(Cornelissen et al ., 2003 ).本研究中, 羊草SRL 在中N水平最低, 而在低N和高N水平较高.其原因可能是, 在中N水平, 羊草对养分资源的吸收高于低N水平, 因此羊草降低SRL 以适应较高浓度的养分环境.随着N添加, 高N水平促进了植株的养分周转(Marklein & Houlton, 2012 ), 细根比例增加以满足植物快速生长的养分需求, 因此羊草SRL 又随之增加.本研究中, 羊草的SLA 较为稳定, 在低N、P水平, 植物分配较多的资源于叶片以提高其最大光合潜能, 而随着N、P添加, 羊草生长不受养分限制, 其增加N、P分配也不能提高光合速率, 因而SLA 较为稳定.万宏伟等(2008)认为, 随着N添加导致光资源竞争加剧, 不同物种对光资源的竞争策略和竞争力有显著差异, 而羊草能够通过提高SLA 和叶片N含量提高其对光资源的利用. ...
The effect of nutrient availability on biomass allocation patterns in 27 species of herbaceous plants.
2000
氮素对内蒙古典型草原羊草种群的影响
2
2005
... 羊草(Leymus chinensis )是多年生根茎禾草, 由于其营养繁殖能力很强, 且具有典型的克隆生长特性, 是我国北方典型草原的主要建群种或优势种, 在东北草原和内蒙古草原经常形成大面积的单优种植被(李永宏, 1993 ).自1980年以来, 由于长期的过度放牧, 我国北方草原生态系统的结构和功能严重退化, 羊草种群也受到了明显的影响, 其生物量和密度显著降低(王仁忠, 1997 ; 王玉辉等, 2002 ).养分添加(主要是N素添加)是恢复退化草地生态系统的一种有效手段, 但目前在草地的恢复与治理上应用较少(潘庆民等, 2005 ).因此, 研究羊草对养分添加的响应与适应机制, 对于我国草地生态系统的恢复与管理具有重要意义. ...
... 我们的结果表明, 羊草的地上生物量主要受N添加的影响, 高N水平下, 羊草的地上生物量约为低N水平的3.5倍, 仅在低N水平下, P添加会提高羊草的地上生物量, 说明在N供应水平较低的情况下, P添加对羊草生长有一定的促进作用.羊草的总生物量也主要受N添加的影响, 中N和高N水平羊草的总生物量约为低N水平的2.0-3.0倍.这些结果表明, 羊草的个体生长主要受N素限制, 这与基于野外养分添加实验的研究结果较为一致, 例如: 白雪等(2014) 研究发现N添加对羊草生长具有明显的促进效应, 使其个体生物量显著增加; 潘庆民等(2005) 研究表明N添加显著提高了羊草群落的地上生物量.与地上生物量相反, 羊草的地下生物量主要受P添加的影响, 尤其在中N和高N水平, P添加会显著降低羊草的地下生物量.羊草的根冠比受N、P添加的共同影响, 随着N和P添加的梯度, 根冠比显著降低, 表明N、P添加均促进了植物向地上生物量的分配.此结果与黄菊莹等(2012)通过盆栽实验研究羊草对N、P添加的响应结果较为一致.通过分析N、P在叶片与根系生物量之间的分配, 我们的研究发现N、P添加均显著促进了羊草向叶片生物量的N、P分配, 在高N水平, N、P向叶片生物量的分配比例比低N水平分别高出4.2倍和2.8倍.而且, 羊草的叶片N含量显著高于根系N含量, N、P添加提高了叶片P含量, 但降低了根系P含量, 也表明N、P添加促进了羊草向叶片生物量的N、P分配.Müller等(2000)也认为在养分条件较好时, 植物倾向于将生物量较多地分配于地上部分, 在养分条件较差时则倾向于分配至地下部分. ...
氮素对内蒙古典型草原羊草种群的影响
2
2005
... 羊草(Leymus chinensis )是多年生根茎禾草, 由于其营养繁殖能力很强, 且具有典型的克隆生长特性, 是我国北方典型草原的主要建群种或优势种, 在东北草原和内蒙古草原经常形成大面积的单优种植被(李永宏, 1993 ).自1980年以来, 由于长期的过度放牧, 我国北方草原生态系统的结构和功能严重退化, 羊草种群也受到了明显的影响, 其生物量和密度显著降低(王仁忠, 1997 ; 王玉辉等, 2002 ).养分添加(主要是N素添加)是恢复退化草地生态系统的一种有效手段, 但目前在草地的恢复与治理上应用较少(潘庆民等, 2005 ).因此, 研究羊草对养分添加的响应与适应机制, 对于我国草地生态系统的恢复与管理具有重要意义. ...
... 我们的结果表明, 羊草的地上生物量主要受N添加的影响, 高N水平下, 羊草的地上生物量约为低N水平的3.5倍, 仅在低N水平下, P添加会提高羊草的地上生物量, 说明在N供应水平较低的情况下, P添加对羊草生长有一定的促进作用.羊草的总生物量也主要受N添加的影响, 中N和高N水平羊草的总生物量约为低N水平的2.0-3.0倍.这些结果表明, 羊草的个体生长主要受N素限制, 这与基于野外养分添加实验的研究结果较为一致, 例如: 白雪等(2014) 研究发现N添加对羊草生长具有明显的促进效应, 使其个体生物量显著增加; 潘庆民等(2005) 研究表明N添加显著提高了羊草群落的地上生物量.与地上生物量相反, 羊草的地下生物量主要受P添加的影响, 尤其在中N和高N水平, P添加会显著降低羊草的地下生物量.羊草的根冠比受N、P添加的共同影响, 随着N和P添加的梯度, 根冠比显著降低, 表明N、P添加均促进了植物向地上生物量的分配.此结果与黄菊莹等(2012)通过盆栽实验研究羊草对N、P添加的响应结果较为一致.通过分析N、P在叶片与根系生物量之间的分配, 我们的研究发现N、P添加均显著促进了羊草向叶片生物量的N、P分配, 在高N水平, N、P向叶片生物量的分配比例比低N水平分别高出4.2倍和2.8倍.而且, 羊草的叶片N含量显著高于根系N含量, N、P添加提高了叶片P含量, 但降低了根系P含量, 也表明N、P添加促进了羊草向叶片生物量的N、P分配.Müller等(2000)也认为在养分条件较好时, 植物倾向于将生物量较多地分配于地上部分, 在养分条件较差时则倾向于分配至地下部分. ...
Hierarchical plant responses and diversity loss after nitrogen addition: Testing three functionally-based hypotheses in the Inner Mongolia grassland.
1
2011
... 羊草N、P向叶片的分配比例增加, 主要是因为随着N、P添加, 羊草由对地下养分的竞争逐渐转化为对地上光资源的竞争(Pan et al ., 2011 ; Lan & Bai, 2012 ).这不仅是羊草对养分环境波动的适应, 也有利于其在自然群落中的竞争.因为随着N和P添加, 根系的养分吸收能力逐渐过剩, 将更多的资源分配给地上部分, 植株变得高大, 以利于获得更多的光照(Lan & Bai, 2012 ).SLA 和SRL 反映了植物对光强和土壤养分的获取能力(Cornelissen et al ., 2003 ).本研究中, 羊草SRL 在中N水平最低, 而在低N和高N水平较高.其原因可能是, 在中N水平, 羊草对养分资源的吸收高于低N水平, 因此羊草降低SRL 以适应较高浓度的养分环境.随着N添加, 高N水平促进了植株的养分周转(Marklein & Houlton, 2012 ), 细根比例增加以满足植物快速生长的养分需求, 因此羊草SRL 又随之增加.本研究中, 羊草的SLA 较为稳定, 在低N、P水平, 植物分配较多的资源于叶片以提高其最大光合潜能, 而随着N、P添加, 羊草生长不受养分限制, 其增加N、P分配也不能提高光合速率, 因而SLA 较为稳定.万宏伟等(2008)认为, 随着N添加导致光资源竞争加剧, 不同物种对光资源的竞争策略和竞争力有显著差异, 而羊草能够通过提高SLA 和叶片N含量提高其对光资源的利用. ...
Leaf phosphorus influences the photosynthesis-nitrogen relation: A cross-biome analysis of 314 species.
2009
Effects of phosphorus deficiency on the photosynthesis and respiration of leaves of sugar beet.
1
1973
... 羊草在对养分添加做出响应的同时, 虽然其生物量和生理性状有显著响应, 但也具有保持生物计量化学稳定的特性, 即相对于变化的外界养分供应而言, 植物在一定范围内具有保持自身N:P稳定的能力(Elser et al ., 2000 ; Zhang et al ., 2003 ).本实验结果也表明, 尽管羊草组织(叶片和根系)的N或P含量对养分添加有着较明显的响应, 但羊草的叶片N:P始终保持在12-15之间, 而在较高的N和P添加水平, 羊草的N:P基本维持在14-15左右, 与传统的养分限制理论中以N:P为14或16作为区分N或P限制的阈值较为相符(Koerselman & Meuleman, 1996 ).我们的研究还发现在盆栽实验中, N和P的作用在一定程度上是互补的.一般认为叶片N含量是直接与植物光合能力相关的指标, 本实验中高N处理下羊草叶片的N含量显著高于其他处理, 但从光合速率的数据看, 高N下叶片光合速率并没有随之升高, 而是随着P添加的增加而显著上升, 说明在本实验中, P可能是羊草光合作用的重要限制因子.早期的一些研究发现部分植物的光合作用是受到P限制的(Terry & Ulrich, 1973 ; Lapointe, 1987 ), 而Reich等(2009)通过对多个生态系统的整合分析, 发现整体来看叶片N和P含量均与其最大光合速率显著相关(p < 0.0001), 但全因子的回归模型显示N是主因子(p < 0.0001, R 2 = 0.52), 而N和P有着显著的交互 作用. ...
羊草草原群落6种植物叶片功能特性对氮素添加的响应
2
2008
... 和N一样, P也是植物生长的主要养分限制因子, 因此N素和P素添加均被用于恢复退化的草地生态系统, 以恢复生态系统的生产力.目前, 关于羊草功能性状对养分添加响应的研究多集中在N素添加(Chen et al ., 2005 ; 万宏伟等, 2008 ; Bai et al ., 2010 ; Lan & Bai, 2012 ; Lü et al ., 2013 ), 而关于P添加以及N和P交互作用对羊草功能性状的影响研究得较少(黄菊莹等, 2012 ; 白雪等, 2014 ), 相关机制尚不十分清楚.白雪等(2014)发现, 尽管羊草草原主要受N素限制, 但在一定条件下也受P素限制.因此, 关于P添加对羊草植物功能性状的影响近年来逐渐受到关注.例如, 白雪等(2014)研究发现, P添加提高了羊草的叶片N和P含量; 黄菊莹等(2012)的研究表明随着P添加梯度增加, 羊草的根冠比降低.而 且, N供应水平的变化也影响了羊草对P的吸收 (Marklein & Houlton, 2012 ), 因此, N、P供应比例的改变可能会对植物功能性状产生较大的影响.通过控制实验, 开展不同N添加水平下植物对P添加梯度的响应与适应机制的研究, 有助于更好地理解植物对养分环境波动的适应能力. ...
... 以往关于羊草对养分添加的实验研究多是在野外的自然生境中进行的(Chen et al ., 2005 ; 万宏伟等, 2008 ; Lan & Bai, 2012 ; Lü et al ., 2013 ; 白雪等, 2014 ), 或是通过盆栽实验, 但只针对某一方面的生理生态特性进行研究(王云龙等, 2004 ; Xu & Zhou, 2006 ).相比以往研究, 本研究通过盆栽实验, 利用温室控制稳定的温度和湿度, 添加定量的有效态N和P, 排除了气候变化、环境异质性和群落内物种竞争等干扰因素.本实验设计了低、中、高3个N和P梯度及其交互作用, 以更好地模拟养分供应的不同比例, 较为系统地测定了羊草的地上、地下关键功能性状, 以期更好地揭示羊草对不同养分环境的响应及适应机制. ...
羊草草原群落6种植物叶片功能特性对氮素添加的响应
2
2008
... 和N一样, P也是植物生长的主要养分限制因子, 因此N素和P素添加均被用于恢复退化的草地生态系统, 以恢复生态系统的生产力.目前, 关于羊草功能性状对养分添加响应的研究多集中在N素添加(Chen et al ., 2005 ; 万宏伟等, 2008 ; Bai et al ., 2010 ; Lan & Bai, 2012 ; Lü et al ., 2013 ), 而关于P添加以及N和P交互作用对羊草功能性状的影响研究得较少(黄菊莹等, 2012 ; 白雪等, 2014 ), 相关机制尚不十分清楚.白雪等(2014)发现, 尽管羊草草原主要受N素限制, 但在一定条件下也受P素限制.因此, 关于P添加对羊草植物功能性状的影响近年来逐渐受到关注.例如, 白雪等(2014)研究发现, P添加提高了羊草的叶片N和P含量; 黄菊莹等(2012)的研究表明随着P添加梯度增加, 羊草的根冠比降低.而 且, N供应水平的变化也影响了羊草对P的吸收 (Marklein & Houlton, 2012 ), 因此, N、P供应比例的改变可能会对植物功能性状产生较大的影响.通过控制实验, 开展不同N添加水平下植物对P添加梯度的响应与适应机制的研究, 有助于更好地理解植物对养分环境波动的适应能力. ...
... 以往关于羊草对养分添加的实验研究多是在野外的自然生境中进行的(Chen et al ., 2005 ; 万宏伟等, 2008 ; Lan & Bai, 2012 ; Lü et al ., 2013 ; 白雪等, 2014 ), 或是通过盆栽实验, 但只针对某一方面的生理生态特性进行研究(王云龙等, 2004 ; Xu & Zhou, 2006 ).相比以往研究, 本研究通过盆栽实验, 利用温室控制稳定的温度和湿度, 添加定量的有效态N和P, 排除了气候变化、环境异质性和群落内物种竞争等干扰因素.本实验设计了低、中、高3个N和P梯度及其交互作用, 以更好地模拟养分供应的不同比例, 较为系统地测定了羊草的地上、地下关键功能性状, 以期更好地揭示羊草对不同养分环境的响应及适应机制. ...
放牧影响下羊草草地主要植物种群生态位宽度与生态位重叠的研究
1
1997
... 羊草(Leymus chinensis )是多年生根茎禾草, 由于其营养繁殖能力很强, 且具有典型的克隆生长特性, 是我国北方典型草原的主要建群种或优势种, 在东北草原和内蒙古草原经常形成大面积的单优种植被(李永宏, 1993 ).自1980年以来, 由于长期的过度放牧, 我国北方草原生态系统的结构和功能严重退化, 羊草种群也受到了明显的影响, 其生物量和密度显著降低(王仁忠, 1997 ; 王玉辉等, 2002 ).养分添加(主要是N素添加)是恢复退化草地生态系统的一种有效手段, 但目前在草地的恢复与治理上应用较少(潘庆民等, 2005 ).因此, 研究羊草对养分添加的响应与适应机制, 对于我国草地生态系统的恢复与管理具有重要意义. ...
放牧影响下羊草草地主要植物种群生态位宽度与生态位重叠的研究
1
1997
... 羊草(Leymus chinensis )是多年生根茎禾草, 由于其营养繁殖能力很强, 且具有典型的克隆生长特性, 是我国北方典型草原的主要建群种或优势种, 在东北草原和内蒙古草原经常形成大面积的单优种植被(李永宏, 1993 ).自1980年以来, 由于长期的过度放牧, 我国北方草原生态系统的结构和功能严重退化, 羊草种群也受到了明显的影响, 其生物量和密度显著降低(王仁忠, 1997 ; 王玉辉等, 2002 ).养分添加(主要是N素添加)是恢复退化草地生态系统的一种有效手段, 但目前在草地的恢复与治理上应用较少(潘庆民等, 2005 ).因此, 研究羊草对养分添加的响应与适应机制, 对于我国草地生态系统的恢复与管理具有重要意义. ...
放牧强度对羊草草原的影响
1
2002
... 羊草(Leymus chinensis )是多年生根茎禾草, 由于其营养繁殖能力很强, 且具有典型的克隆生长特性, 是我国北方典型草原的主要建群种或优势种, 在东北草原和内蒙古草原经常形成大面积的单优种植被(李永宏, 1993 ).自1980年以来, 由于长期的过度放牧, 我国北方草原生态系统的结构和功能严重退化, 羊草种群也受到了明显的影响, 其生物量和密度显著降低(王仁忠, 1997 ; 王玉辉等, 2002 ).养分添加(主要是N素添加)是恢复退化草地生态系统的一种有效手段, 但目前在草地的恢复与治理上应用较少(潘庆民等, 2005 ).因此, 研究羊草对养分添加的响应与适应机制, 对于我国草地生态系统的恢复与管理具有重要意义. ...
放牧强度对羊草草原的影响
1
2002
... 羊草(Leymus chinensis )是多年生根茎禾草, 由于其营养繁殖能力很强, 且具有典型的克隆生长特性, 是我国北方典型草原的主要建群种或优势种, 在东北草原和内蒙古草原经常形成大面积的单优种植被(李永宏, 1993 ).自1980年以来, 由于长期的过度放牧, 我国北方草原生态系统的结构和功能严重退化, 羊草种群也受到了明显的影响, 其生物量和密度显著降低(王仁忠, 1997 ; 王玉辉等, 2002 ).养分添加(主要是N素添加)是恢复退化草地生态系统的一种有效手段, 但目前在草地的恢复与治理上应用较少(潘庆民等, 2005 ).因此, 研究羊草对养分添加的响应与适应机制, 对于我国草地生态系统的恢复与管理具有重要意义. ...
水分胁迫对羊草光合产物分配及其气体交换特征的影响
1
2004
... 以往关于羊草对养分添加的实验研究多是在野外的自然生境中进行的(Chen et al ., 2005 ; 万宏伟等, 2008 ; Lan & Bai, 2012 ; Lü et al ., 2013 ; 白雪等, 2014 ), 或是通过盆栽实验, 但只针对某一方面的生理生态特性进行研究(王云龙等, 2004 ; Xu & Zhou, 2006 ).相比以往研究, 本研究通过盆栽实验, 利用温室控制稳定的温度和湿度, 添加定量的有效态N和P, 排除了气候变化、环境异质性和群落内物种竞争等干扰因素.本实验设计了低、中、高3个N和P梯度及其交互作用, 以更好地模拟养分供应的不同比例, 较为系统地测定了羊草的地上、地下关键功能性状, 以期更好地揭示羊草对不同养分环境的响应及适应机制. ...
水分胁迫对羊草光合产物分配及其气体交换特征的影响
1
2004
... 以往关于羊草对养分添加的实验研究多是在野外的自然生境中进行的(Chen et al ., 2005 ; 万宏伟等, 2008 ; Lan & Bai, 2012 ; Lü et al ., 2013 ; 白雪等, 2014 ), 或是通过盆栽实验, 但只针对某一方面的生理生态特性进行研究(王云龙等, 2004 ; Xu & Zhou, 2006 ).相比以往研究, 本研究通过盆栽实验, 利用温室控制稳定的温度和湿度, 添加定量的有效态N和P, 排除了气候变化、环境异质性和群落内物种竞争等干扰因素.本实验设计了低、中、高3个N和P梯度及其交互作用, 以更好地模拟养分供应的不同比例, 较为系统地测定了羊草的地上、地下关键功能性状, 以期更好地揭示羊草对不同养分环境的响应及适应机制. ...
羊草生长率的研究和生长率假说的验证
1
2013
... 关于羊草的功能性状对N素添加的响应及其适应策略, 已经开展了较多的研究, 但在不同组织水平下, 研究结果也不尽相同.例如, 在生态计量化学方面, 通过在内蒙古典型草原进行的养分添加实验研究发现: N添加提高了羊草的叶片N含量, 但对叶片P含量没有显著影响(白雪等, 2014 ).N添加也能显著提高羊草绿叶和衰老叶片的N、P含量, 从而降低叶片对N和P的再吸收, 整体上提高N和P在植物体内的周转速率(Lü et al ., 2013 ).根据生长速率假说(growth rate hypothesis), 羊草的生长速率与全P含量存在正相关关系, 而与N:P存在负相关关系, 不同来源的羊草种植在同一环境条件下, 来自N、P含量较高土壤的羊草具有较高的生长速率, 这可能是羊草对特定地域生境条件长期适应的结果(徐劲草和许新宜, 2013 ).也有研究发现, 羊草植株的N:P随着N添加在一定范围内保持稳定(Zhang et al ., 2004 ).从生理特性方面, Chen等(2005)研究发现, N添加能够提高羊草的最大光合速率, 但对羊草的净光合速率、蒸腾速率和气孔导度没有显著影响; 随着N添加梯度加大, 羊草的水分利用效率增加, 而N素利用效率降低.万宏伟等(2008)研究发现羊草通过增加比叶面积(SLA )和叶片N含量提高对光的竞争能力.白雪等(2014)研究发现, 羊草对N添加的响应因组织水平而异, 也受年际间降水变化的影响, 羊草通过增加SLA、 叶片大小和叶片N含量, 提高整体光合能力, 从而促进个体生长.这些结果主要是定性描述羊草对N变化的生理生态响应, 并没有在机理上对这些响应做出解释. ...
羊草生长率的研究和生长率假说的验证
1
2013
... 关于羊草的功能性状对N素添加的响应及其适应策略, 已经开展了较多的研究, 但在不同组织水平下, 研究结果也不尽相同.例如, 在生态计量化学方面, 通过在内蒙古典型草原进行的养分添加实验研究发现: N添加提高了羊草的叶片N含量, 但对叶片P含量没有显著影响(白雪等, 2014 ).N添加也能显著提高羊草绿叶和衰老叶片的N、P含量, 从而降低叶片对N和P的再吸收, 整体上提高N和P在植物体内的周转速率(Lü et al ., 2013 ).根据生长速率假说(growth rate hypothesis), 羊草的生长速率与全P含量存在正相关关系, 而与N:P存在负相关关系, 不同来源的羊草种植在同一环境条件下, 来自N、P含量较高土壤的羊草具有较高的生长速率, 这可能是羊草对特定地域生境条件长期适应的结果(徐劲草和许新宜, 2013 ).也有研究发现, 羊草植株的N:P随着N添加在一定范围内保持稳定(Zhang et al ., 2004 ).从生理特性方面, Chen等(2005)研究发现, N添加能够提高羊草的最大光合速率, 但对羊草的净光合速率、蒸腾速率和气孔导度没有显著影响; 随着N添加梯度加大, 羊草的水分利用效率增加, 而N素利用效率降低.万宏伟等(2008)研究发现羊草通过增加比叶面积(SLA )和叶片N含量提高对光的竞争能力.白雪等(2014)研究发现, 羊草对N添加的响应因组织水平而异, 也受年际间降水变化的影响, 羊草通过增加SLA、 叶片大小和叶片N含量, 提高整体光合能力, 从而促进个体生长.这些结果主要是定性描述羊草对N变化的生理生态响应, 并没有在机理上对这些响应做出解释. ...
Combined effects of water stress and high temperature on photosynthesis, nitrogen metabolism and lipid peroxidation of a perennial grass Leymus chinensis.
1
2006
... 以往关于羊草对养分添加的实验研究多是在野外的自然生境中进行的(Chen et al ., 2005 ; 万宏伟等, 2008 ; Lan & Bai, 2012 ; Lü et al ., 2013 ; 白雪等, 2014 ), 或是通过盆栽实验, 但只针对某一方面的生理生态特性进行研究(王云龙等, 2004 ; Xu & Zhou, 2006 ).相比以往研究, 本研究通过盆栽实验, 利用温室控制稳定的温度和湿度, 添加定量的有效态N和P, 排除了气候变化、环境异质性和群落内物种竞争等干扰因素.本实验设计了低、中、高3个N和P梯度及其交互作用, 以更好地模拟养分供应的不同比例, 较为系统地测定了羊草的地上、地下关键功能性状, 以期更好地揭示羊草对不同养分环境的响应及适应机制. ...
Application of N:P stoichiometry to ecology studies.
1
2003
... 羊草在对养分添加做出响应的同时, 虽然其生物量和生理性状有显著响应, 但也具有保持生物计量化学稳定的特性, 即相对于变化的外界养分供应而言, 植物在一定范围内具有保持自身N:P稳定的能力(Elser et al ., 2000 ; Zhang et al ., 2003 ).本实验结果也表明, 尽管羊草组织(叶片和根系)的N或P含量对养分添加有着较明显的响应, 但羊草的叶片N:P始终保持在12-15之间, 而在较高的N和P添加水平, 羊草的N:P基本维持在14-15左右, 与传统的养分限制理论中以N:P为14或16作为区分N或P限制的阈值较为相符(Koerselman & Meuleman, 1996 ).我们的研究还发现在盆栽实验中, N和P的作用在一定程度上是互补的.一般认为叶片N含量是直接与植物光合能力相关的指标, 本实验中高N处理下羊草叶片的N含量显著高于其他处理, 但从光合速率的数据看, 高N下叶片光合速率并没有随之升高, 而是随着P添加的增加而显著上升, 说明在本实验中, P可能是羊草光合作用的重要限制因子.早期的一些研究发现部分植物的光合作用是受到P限制的(Terry & Ulrich, 1973 ; Lapointe, 1987 ), 而Reich等(2009)通过对多个生态系统的整合分析, 发现整体来看叶片N和P含量均与其最大光合速率显著相关(p < 0.0001), 但全因子的回归模型显示N是主因子(p < 0.0001, R 2 = 0.52), 而N和P有着显著的交互 作用. ...
Differential responses of N:P stoichiometry of Leymus chinensis and Carex korshinskyi to N additions in a steppe ecosystem in Nei Mongol.
1
2004
... 关于羊草的功能性状对N素添加的响应及其适应策略, 已经开展了较多的研究, 但在不同组织水平下, 研究结果也不尽相同.例如, 在生态计量化学方面, 通过在内蒙古典型草原进行的养分添加实验研究发现: N添加提高了羊草的叶片N含量, 但对叶片P含量没有显著影响(白雪等, 2014 ).N添加也能显著提高羊草绿叶和衰老叶片的N、P含量, 从而降低叶片对N和P的再吸收, 整体上提高N和P在植物体内的周转速率(Lü et al ., 2013 ).根据生长速率假说(growth rate hypothesis), 羊草的生长速率与全P含量存在正相关关系, 而与N:P存在负相关关系, 不同来源的羊草种植在同一环境条件下, 来自N、P含量较高土壤的羊草具有较高的生长速率, 这可能是羊草对特定地域生境条件长期适应的结果(徐劲草和许新宜, 2013 ).也有研究发现, 羊草植株的N:P随着N添加在一定范围内保持稳定(Zhang et al ., 2004 ).从生理特性方面, Chen等(2005)研究发现, N添加能够提高羊草的最大光合速率, 但对羊草的净光合速率、蒸腾速率和气孔导度没有显著影响; 随着N添加梯度加大, 羊草的水分利用效率增加, 而N素利用效率降低.万宏伟等(2008)研究发现羊草通过增加比叶面积(SLA )和叶片N含量提高对光的竞争能力.白雪等(2014)研究发现, 羊草对N添加的响应因组织水平而异, 也受年际间降水变化的影响, 羊草通过增加SLA、 叶片大小和叶片N含量, 提高整体光合能力, 从而促进个体生长.这些结果主要是定性描述羊草对N变化的生理生态响应, 并没有在机理上对这些响应做出解释. ...