谷子及其根际土壤微生物群落对铬胁迫的响应机制
白雪, 李玉靖, 景秀清, 赵晓东, 畅莎莎, 荆韬羽, 刘晋汝, 赵鹏宇
植物生态学报
2023, 47 ( 3):
418-433.
DOI: 10.17521/cjpe.2022.0049
重金属铬(Cr)污染对农田中农作物产生毒害作用并破坏土壤微生物群落稳态, 但不同农作物及其根际土壤微生物群落对Cr胁迫的响应机制均有所差异。该研究在时间序列上分析Cr胁迫对谷子(正名: 粱, Setaria italica)长势、谷子差异表达基因(DEGs)的功能途径及土壤微生物群落结构和功能等方面的影响, 阐明谷子及土壤微生物群落的响应机制, 为Cr胁迫下的谷子生长及污染土壤的生态修复治理提供理论依据。基于室内盆栽实验, 以谷子幼苗和种植谷子的土壤为实验材料, 在Cr胁迫前(CK)及胁迫后6 h和6 d (Cr_6h、Cr_6d)的时间序列上分别进行样本采集, 同时测量幼苗生理性状指标及土壤理化指标。通过转录组分析, 研究Cr胁迫时间序列上谷子幼苗基因表达及所富集的功能途径的变化趋势; 通过高通量测序分析, 研究Cr胁迫时间序列上土壤微生物群落结构、物种多样性、群落功能的动态变化过程及与土壤理化性质的相关性。结果发现: 1)转录组分析结果表明Cr胁迫诱导基因表达上调(上调DEGs 54%); Gene Ontology (GO)富集分析表明DEGs在CK和Cr_6h、Cr_6h和Cr_6d样本对中与光合作用相关的基因的表达显著下调; 在Cr_6h和Cr_6d样本对中与防御和损伤调控相关的基因的表达显著上调, 细胞壁及细胞膜和细胞分裂相关基因的表达下调。2)高通量测序结果表明Cr胁迫时间序列上土壤细菌与真菌在门、属水平组成变化显著; 细菌群落α多样性呈现出由应激到稳定的阶段性变化特征(CK、Cr_6h和Cr_6d的Shannon多样性指数分别为6.09、5.93和6.05; Simpson多样性指数分别为0.006 8、0.007 8和0.006 8; Chao多样性指数分别为2 818.49、2 630.73和2 769.38), 而真菌群落α多样性显著下降(Shannon-Wiener多样性指数分别为4.17、3.81和3.23); 细菌与真菌群落的β多样性在Cr胁迫时间序列的分布差异显著。3)土壤理化性质与微生物群落相关性分析表明土壤理化因子与多种真菌群落显著相关, 而与细菌群落的关联关系较弱。结果表明Cr胁迫在时间序列上通过降低叶绿素含量、光系统活性并影响类囊体等结构组分显著抑制了谷子幼苗的光合作用过程, 通过下调细胞壁及微管相关组分基因表达抑制叶片细胞的增殖分化过程, 但同时激活了植物防御系统以降低自身所受的毒害作用。同时土壤细菌与真菌群落通过群落组成结构及多样性的变化来适应Cr胁迫, 二者在胁迫时间序列上的响应程度和策略均有所不同。
| 指标 Index | 对照 Control | Cr胁迫6 h Cr stress for 6 h | Cr胁迫6 d Cr stress for 6 d | | 茎长 Stem length (cm) | 5.86 ± 0.55b | 5.52 ± 0.55b | 7.73 ± 1.12a | | 根长 Root length (cm) | 4.18 ± 0.81a | 3.64 ± 0.23a | 3.83 ± 0.75a | | 干质量 Dry mass (g) | 0.003 1 ± 0.000 5b | 0.003 4 ± 0.000 5b | 0.005 0 ± 0.000 6a | | 鲜质量 Fresh mass (g) | 0.028 3 ± 0.005 3b | 0.029 4 ± 0.002 6b | 0.037 8 ± 0.005 1a | | 叶绿素含量 Chlorophyll content (SPAD) | 24.68 ± 1.70a | 18.84 ± 1.77b | 16.34 ± 2.00b | | 氮含量 Nitrogen content (mg·g-1) | 7.49 ± 0.51a | 6.19 ± 0.52b | 5.45 ± 0.58b |
View table in article
表2
铬(Cr)胁迫时间序列上谷子长势及生物量测定(平均值±标准差)
正文中引用本图/表的段落
重金属铬(Cr)污染对农田中农作物产生毒害作用并破坏土壤微生物群落稳态, 但不同农作物及其根际土壤微生物群落对Cr胁迫的响应机制均有所差异。该研究在时间序列上分析Cr胁迫对谷子(正名: 粱, Setaria italica)长势、谷子差异表达基因(DEGs)的功能途径及土壤微生物群落结构和功能等方面的影响, 阐明谷子及土壤微生物群落的响应机制, 为Cr胁迫下的谷子生长及污染土壤的生态修复治理提供理论依据。基于室内盆栽实验, 以谷子幼苗和种植谷子的土壤为实验材料, 在Cr胁迫前(CK)及胁迫后6 h和6 d (Cr_6h、Cr_6d)的时间序列上分别进行样本采集, 同时测量幼苗生理性状指标及土壤理化指标。通过转录组分析, 研究Cr胁迫时间序列上谷子幼苗基因表达及所富集的功能途径的变化趋势; 通过高通量测序分析, 研究Cr胁迫时间序列上土壤微生物群落结构、物种多样性、群落功能的动态变化过程及与土壤理化性质的相关性。结果发现: 1)转录组分析结果表明Cr胁迫诱导基因表达上调(上调DEGs 54%); Gene Ontology (GO)富集分析表明DEGs在CK和Cr_6h、Cr_6h和Cr_6d样本对中与光合作用相关的基因的表达显著下调; 在Cr_6h和Cr_6d样本对中与防御和损伤调控相关的基因的表达显著上调, 细胞壁及细胞膜和细胞分裂相关基因的表达下调。2)高通量测序结果表明Cr胁迫时间序列上土壤细菌与真菌在门、属水平组成变化显著; 细菌群落α多样性呈现出由应激到稳定的阶段性变化特征(CK、Cr_6h和Cr_6d的Shannon多样性指数分别为6.09、5.93和6.05; Simpson多样性指数分别为0.006 8、0.007 8和0.006 8; Chao多样性指数分别为2 818.49、2 630.73和2 769.38), 而真菌群落α多样性显著下降(Shannon-Wiener多样性指数分别为4.17、3.81和3.23); 细菌与真菌群落的β多样性在Cr胁迫时间序列的分布差异显著。3)土壤理化性质与微生物群落相关性分析表明土壤理化因子与多种真菌群落显著相关, 而与细菌群落的关联关系较弱。结果表明Cr胁迫在时间序列上通过降低叶绿素含量、光系统活性并影响类囊体等结构组分显著抑制了谷子幼苗的光合作用过程, 通过下调细胞壁及微管相关组分基因表达抑制叶片细胞的增殖分化过程, 但同时激活了植物防御系统以降低自身所受的毒害作用。同时土壤细菌与真菌群落通过群落组成结构及多样性的变化来适应Cr胁迫, 二者在胁迫时间序列上的响应程度和策略均有所不同。
为定量分析基因的表达水平, 使用RSEM 1.3.3计算基因表达值, 定量指标为TPM (transcripts per million), 通过对基因长度和测序深度进行均一化处理, 使不同样本中总表达量一致, 直观观测基因间的表达量差异。采用Blast 2.9.0软件将基因与Gene Ontology (GO)数据库进行比对, 获得差异表达基因(DEGs)的注释信息。GO注释分析根据功能不同可分为分子功能(molecular_function, MF)、细胞组成(cellular_component, CC)和生物过程(biological_process, BP) 三大类, 并通过GO富集分析进行进一步的功能富集分析, 以明确植物幼苗受到调控的具体功能类别。采用DESeq2 1.24.0软件, 通过多次检查和校正将Cr胁迫下样品(Cr_6h、Cr_6d)与对照样本(CK)进行比较, 并以p < 0.01且|log2FC| ≥ 2 (FC, 差异表达倍数)作为筛选DEGs的阈值。
用软件R 4.1.2、SPSS 19.0及Excel 2010辅助数据分析与作图。利用单因素方差分析(ANOVA)评估Cr胁迫时间序列上土壤理化因子、植物生理指标及生物量、土壤中细菌与真菌群落的物种组成、多样性等; 通过火山图明确Cr胁迫时间序列上DEGs的上下调状况; 通过GO功能注释与富集分析明确DEGs功能表达差异; 利用Sobs指数、Shannon多样性指数等探究土壤微生物群落的α多样性; 利用非度量多维尺度分析(NMDS)对Cr胁迫后时间序列上土壤微生物群落的时空分布格局进行排序分析; 利用PICRUSt 2、FUNGuild功能预测, 划分对环境资源吸收与利用相似的类群。
通过测量植物茎长、根长、干质量、鲜质量、叶绿素含量、N含量分析Cr胁迫在时间序列上对谷子长势的影响(图1)。结果表明Cr_6d与Cr_6h相比, 植株的茎长、干质量、鲜质量分别显著增加了40.04%、47.06%、28.57%, 根长无显著变化; 而与CK相比, Cr_6h叶绿素与N含量分别显著下降23.66%、17.36% (表2)。
Venn图(图4A、4B)分析表明, 细菌中共检测出2 763个共有OTUs (占所有OTUs的78.74%), CK、Cr_6h和Cr_6d阶段特有OTUs分别为81 (2.31%)、24 (0.68%)、69 (1.97%); 真菌中共检测出578个共有OTUs (占所有OTUs的44.33%), CK、Cr_6h和Cr_6d阶段特有OTUs分别为170 (13.04%)、155 (11.89%)和118 (9.05%)。
另外, Cr胁迫抑制了叶片中光合作用相关基因的表达。根据表2, 随Cr胁迫时间增长谷子叶片中叶绿素含量显著下降, 且GO富集分析表明在CK和Cr_6d样本对中的光合作用光反应与暗反应、光系统I与光系统II等基因表达均显著下调。可能在于Cr可降解参与叶绿素生物合成的重要酶——氨基乙酰丙酸脱水酶, 降低了细胞中的叶绿素水平(Vajpayee et al., 2001), 与Cr处理小麦中叶绿素含量降低的结果(Subrahmanyam, 2008)相一致。同时Cr毒性抑制光系统中的光合成复合物、影响电子传递效率、降低光系统II (PSII)反应中心的活性并导致PSII的异质性即结构与功能多样性的变化(Mathur et al., 2016)。且GO富集分析表明3组样本对中类囊体膜、质体类囊体膜等基因表达均显著下调, 可能在于Cr(VI)毒性引起类囊体畸变, 对光合作用产生负面影响使细胞内能量转移失衡(Ali et al., 2013)。光合作用相关组分基因表达下调降低了光合作用效率, 影响了植物细胞中营养物质的吸收及转运, 最终可能抑制谷子叶片的生物量及植株生长。
本文的其它图/表
-
 表1
铬(Cr)胁迫下土壤理化性质(平均值±标准差)
表1
铬(Cr)胁迫下土壤理化性质(平均值±标准差)
-
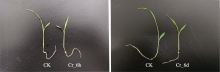 图1
铬(Cr)胁迫后谷子幼苗形态的变化。CK, 对照; Cr_6d, Cr胁迫6 d; Cr_6h, Cr胁迫6 h。
图1
铬(Cr)胁迫后谷子幼苗形态的变化。CK, 对照; Cr_6d, Cr胁迫6 d; Cr_6h, Cr胁迫6 h。
-
 图2
铬(Cr)胁迫时间序列上谷子叶片中的差异表达基因(DEGs)。A-C, CK、Cr_6h、Cr_6d处理中谷子叶片DEGs火山图。蓝点、红点、灰点分别代表下调、上调和无显著变化基因。D, 不同处理谷子叶片中的DEGs Venn图。E, Cr胁迫下谷子叶片中DEGs的GO注释分析。CK, 对照; Cr_6d, Cr胁迫6 d; Cr_6h; Cr胁迫6 h。FC, 差异表达倍数; pa, 矫正的p值。
图2
铬(Cr)胁迫时间序列上谷子叶片中的差异表达基因(DEGs)。A-C, CK、Cr_6h、Cr_6d处理中谷子叶片DEGs火山图。蓝点、红点、灰点分别代表下调、上调和无显著变化基因。D, 不同处理谷子叶片中的DEGs Venn图。E, Cr胁迫下谷子叶片中DEGs的GO注释分析。CK, 对照; Cr_6d, Cr胁迫6 d; Cr_6h; Cr胁迫6 h。FC, 差异表达倍数; pa, 矫正的p值。
-
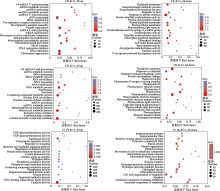 图3
铬(Cr)胁迫下谷子叶片中差异表达基因(DEGs)的Gene Ontology (GO)富集分析。down, 下调; up, 上调。CK, 对照; Cr_6d, Cr胁迫6 d ; Cr_6h, Cr胁迫6 h。9-cis-epoxycarotenoid dioxygenase activity, 9-顺式-环氧类胡萝卜素双加氧酶活性; Alcohol group as acceptor, 醇基作为受体; Amylase activity, 淀粉酶活性; Amylopectin maltohydrolase activity, 支链淀粉麦芽糖水解酶活性; Anchored component of membrance, 膜的锚定成分; Anchored component of plasma membrane, 质膜的锚定成分; Apoplast, 质外体; Beta-amylase activity, β-淀粉酶活性; Catalytic activity, 催化活性; Cell redox homeostasis, 细胞氧化还原稳态; Cell wall organization or biogenesis, 细胞壁组织或生物发生; Cellular aromatic compound metabolic, 细胞芳香族化合物代谢; Chlorophy II binding, 叶绿素II结合; Chloroplast envelope, 叶绿体包膜; Chloroplast thylakoid membrance, 叶绿体类囊体膜; Cloroplast organization, 叶绿体组织; Containing compound metabolic process, 含复合代谢过程; Containing compound metabolic process, 含化合物代谢过程; Disulfide oxidoreductase activity, 二硫键氧化还原酶活性; DNA replication initiation, DNA复制起始; DNA replication, DNA复制; DNA-binding transcription factor activity, DNA结合转录因子活性; Electron transport chain, 电子传递链; Exoribonuclease complex, 外核糖核酸酶复合物; Exosome (RNase complex), 外泌体(核糖核酸酶复合物); Hetercycle metabolic process, 杂环代谢过程; Hydrogen peroxide catabolic process, 过氧化氢分解代谢过程; Hydrogen peroxide metabolic process, 过氧化氢代谢过程; Isoprenoid catabolic process, 类异戊二烯分解代谢过程; Jasmonic acid mediated signaling pathway, 茉莉酸介导的信号通路; Kinase activity, 激酶活性; Kinesin complex, 驱动蛋白复合物; Light harvesting in photosystem I, 光系统I光捕获; Magnesium-dependent protein serine, 镁依赖性蛋白丝氨酸; MCM complex, MCM复合物; Microtubule associated complex, 微管相关复合物; Microtubule, 微管; Microtubule-based movement, 基于微管的运动; Mitochondrial RNA metabolic process, 线粒体RNA代谢过程; Mitochondrial RNA modification, 线粒体RNA修饰; Movement of cell or subcellular component, 细胞或亚细胞成分的运动; mRNA modification, mRNA修饰; ncRNA metabolic processing, ncRNA代谢过程; ncRNA processing, ncRNA加工; Nuclear exosome (RNase complex), 核外泌体(核糖核酸酶复合体); Nucleolus, 核仁; Oxidoreductase activity acting on a sulfur group, 作用于硫的氧化还原酶活性; Oxidoreductase activity, 氧化还原酶活性; Phosphatase activity, 磷酸酶活性; Phosphoric ester hydrolase activity, 磷酸酯水解酶活性; Phosphorus metabolism process, 磷代谢过程; Phosphprylation, 磷酸化; Photosynthesis dark reaction, 光合作用暗反应; Photosynthesis light harvesting, 光合作用光捕获; Photosynthesis light reaction, 光合作用光反应; Photosynthesis, 光合作用; Photosynthetic membrane, 光合膜; Photosystem I, 光系统I; Photosystem II oxygen evolving complex, 光系统II氧演替复合物; Photosystem, 光系统; Photosythetic electron transport chain, 光合电子传递链; Plastic organization, 塑料组织; Plastid envelope, 质体包膜; Plastid processing, 质体加工; Plastid thylakoid membrance, 质体类囊体膜; Polymeric cytoskeletal fiber, 聚合细胞骨架纤维; Pre-replicative complex assembly in cell, 细胞内复制前复合物组装; Pre-replicative complex assembly, 复制前复合物组装; Preribosome, nucleolus, 前核糖体; Protein disulfide oxidoreductase activity, 蛋白质二硫键氧化还原酶活性; Protein kinase activity, 蛋白激酶活性; Protein serine/threonine kinase activity, 蛋白丝氨酸/苏氨酸激酶活性; Protein-chromophore linkage, 蛋白质-发色团键; Protein-chromophore linkage, 蛋白质-发色团连接; Reactive oxygen species metabolic process, 活性氧代谢过程; Reductive pentose-phosphate cycle, 还原性戊糖-磷酸循环; Regulation of defense response, 防御反应的调节; Response to abiotic stimulus, 对非生物刺激的反应; Response to heat, 对热的反应; Response to radiation, 对刺激的反应; Response to wounding, 对创伤的反应; RNA modification, RNA修饰; RNA processing, RNA加工; RNA surveillance, RNA监测; rRNA metabolic processing, rRNA代谢加工; rRNA modification, rRNA修饰; rRNA processing, rRNA加工; Sesquiterpenoid biosynthetic process, 倍半萜类生物合成过程; Sesquiterpenoid metabolic process, 倍半萜类代谢过程; SnoRNA 3?-end processing, snoRNA 3?端加工; snoRNA processing, snoRNA加工; snRNA metabolic process, snRNA代谢过程; Supramolecular fiber, 超分子纤维; Supramolecular polymer, 超分子聚合物; Thylakoid membrane, 类囊体膜; Transcription regulator activity, 转录调节活性; Transferase activity, 转移酶活性; U4 snRNA 3?-end processing, U4 snRNA 3?端加工; UDP-glycosyltransferase activity, UDP-糖基转移酶活性。pa, 矫正的p值。
图3
铬(Cr)胁迫下谷子叶片中差异表达基因(DEGs)的Gene Ontology (GO)富集分析。down, 下调; up, 上调。CK, 对照; Cr_6d, Cr胁迫6 d ; Cr_6h, Cr胁迫6 h。9-cis-epoxycarotenoid dioxygenase activity, 9-顺式-环氧类胡萝卜素双加氧酶活性; Alcohol group as acceptor, 醇基作为受体; Amylase activity, 淀粉酶活性; Amylopectin maltohydrolase activity, 支链淀粉麦芽糖水解酶活性; Anchored component of membrance, 膜的锚定成分; Anchored component of plasma membrane, 质膜的锚定成分; Apoplast, 质外体; Beta-amylase activity, β-淀粉酶活性; Catalytic activity, 催化活性; Cell redox homeostasis, 细胞氧化还原稳态; Cell wall organization or biogenesis, 细胞壁组织或生物发生; Cellular aromatic compound metabolic, 细胞芳香族化合物代谢; Chlorophy II binding, 叶绿素II结合; Chloroplast envelope, 叶绿体包膜; Chloroplast thylakoid membrance, 叶绿体类囊体膜; Cloroplast organization, 叶绿体组织; Containing compound metabolic process, 含复合代谢过程; Containing compound metabolic process, 含化合物代谢过程; Disulfide oxidoreductase activity, 二硫键氧化还原酶活性; DNA replication initiation, DNA复制起始; DNA replication, DNA复制; DNA-binding transcription factor activity, DNA结合转录因子活性; Electron transport chain, 电子传递链; Exoribonuclease complex, 外核糖核酸酶复合物; Exosome (RNase complex), 外泌体(核糖核酸酶复合物); Hetercycle metabolic process, 杂环代谢过程; Hydrogen peroxide catabolic process, 过氧化氢分解代谢过程; Hydrogen peroxide metabolic process, 过氧化氢代谢过程; Isoprenoid catabolic process, 类异戊二烯分解代谢过程; Jasmonic acid mediated signaling pathway, 茉莉酸介导的信号通路; Kinase activity, 激酶活性; Kinesin complex, 驱动蛋白复合物; Light harvesting in photosystem I, 光系统I光捕获; Magnesium-dependent protein serine, 镁依赖性蛋白丝氨酸; MCM complex, MCM复合物; Microtubule associated complex, 微管相关复合物; Microtubule, 微管; Microtubule-based movement, 基于微管的运动; Mitochondrial RNA metabolic process, 线粒体RNA代谢过程; Mitochondrial RNA modification, 线粒体RNA修饰; Movement of cell or subcellular component, 细胞或亚细胞成分的运动; mRNA modification, mRNA修饰; ncRNA metabolic processing, ncRNA代谢过程; ncRNA processing, ncRNA加工; Nuclear exosome (RNase complex), 核外泌体(核糖核酸酶复合体); Nucleolus, 核仁; Oxidoreductase activity acting on a sulfur group, 作用于硫的氧化还原酶活性; Oxidoreductase activity, 氧化还原酶活性; Phosphatase activity, 磷酸酶活性; Phosphoric ester hydrolase activity, 磷酸酯水解酶活性; Phosphorus metabolism process, 磷代谢过程; Phosphprylation, 磷酸化; Photosynthesis dark reaction, 光合作用暗反应; Photosynthesis light harvesting, 光合作用光捕获; Photosynthesis light reaction, 光合作用光反应; Photosynthesis, 光合作用; Photosynthetic membrane, 光合膜; Photosystem I, 光系统I; Photosystem II oxygen evolving complex, 光系统II氧演替复合物; Photosystem, 光系统; Photosythetic electron transport chain, 光合电子传递链; Plastic organization, 塑料组织; Plastid envelope, 质体包膜; Plastid processing, 质体加工; Plastid thylakoid membrance, 质体类囊体膜; Polymeric cytoskeletal fiber, 聚合细胞骨架纤维; Pre-replicative complex assembly in cell, 细胞内复制前复合物组装; Pre-replicative complex assembly, 复制前复合物组装; Preribosome, nucleolus, 前核糖体; Protein disulfide oxidoreductase activity, 蛋白质二硫键氧化还原酶活性; Protein kinase activity, 蛋白激酶活性; Protein serine/threonine kinase activity, 蛋白丝氨酸/苏氨酸激酶活性; Protein-chromophore linkage, 蛋白质-发色团键; Protein-chromophore linkage, 蛋白质-发色团连接; Reactive oxygen species metabolic process, 活性氧代谢过程; Reductive pentose-phosphate cycle, 还原性戊糖-磷酸循环; Regulation of defense response, 防御反应的调节; Response to abiotic stimulus, 对非生物刺激的反应; Response to heat, 对热的反应; Response to radiation, 对刺激的反应; Response to wounding, 对创伤的反应; RNA modification, RNA修饰; RNA processing, RNA加工; RNA surveillance, RNA监测; rRNA metabolic processing, rRNA代谢加工; rRNA modification, rRNA修饰; rRNA processing, rRNA加工; Sesquiterpenoid biosynthetic process, 倍半萜类生物合成过程; Sesquiterpenoid metabolic process, 倍半萜类代谢过程; SnoRNA 3?-end processing, snoRNA 3?端加工; snoRNA processing, snoRNA加工; snRNA metabolic process, snRNA代谢过程; Supramolecular fiber, 超分子纤维; Supramolecular polymer, 超分子聚合物; Thylakoid membrane, 类囊体膜; Transcription regulator activity, 转录调节活性; Transferase activity, 转移酶活性; U4 snRNA 3?-end processing, U4 snRNA 3?端加工; UDP-glycosyltransferase activity, UDP-糖基转移酶活性。pa, 矫正的p值。
-
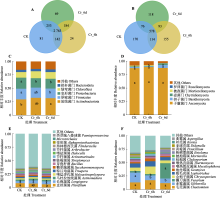 图4
铬(Cr)胁迫时间序列上谷子根际土壤细菌和真菌群落门水平与属水平群落结构及群落间差异。A、B, 细菌和真菌Venn图。图中的数字代表的是不同分组中分类操作单元的个数。C、D, 细菌和真菌门水平群落组成。E、F, 细菌和真菌属水平群落组成。CK, 对照; Cr_6d, Cr胁迫6 d; Cr_6h, Cr胁迫6 h。不同小写字母表示各处理间差异显著(p < 0.05)。
图4
铬(Cr)胁迫时间序列上谷子根际土壤细菌和真菌群落门水平与属水平群落结构及群落间差异。A、B, 细菌和真菌Venn图。图中的数字代表的是不同分组中分类操作单元的个数。C、D, 细菌和真菌门水平群落组成。E、F, 细菌和真菌属水平群落组成。CK, 对照; Cr_6d, Cr胁迫6 d; Cr_6h, Cr胁迫6 h。不同小写字母表示各处理间差异显著(p < 0.05)。
-
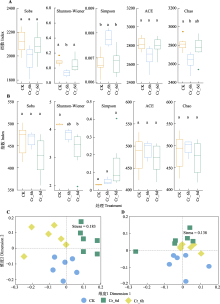 图5
铬(Cr)胁迫时间序列上土壤中细菌(A、C)与真菌(B、D)群落的α多样性及β多样性。A、B, 细菌和真菌群落的α多样性。不同小写字母表示不同处理间差异显著(p < 0.05)。C、D, 细菌和真菌群落的β多样性, 两样本点越接近, 表明两样本物种组成越相似。CK, 对照组; Cr_6d, Cr胁迫6 d ; Cr_6h, Cr胁迫6 h。Stress为反映模型合适程度的指标。
图5
铬(Cr)胁迫时间序列上土壤中细菌(A、C)与真菌(B、D)群落的α多样性及β多样性。A、B, 细菌和真菌群落的α多样性。不同小写字母表示不同处理间差异显著(p < 0.05)。C、D, 细菌和真菌群落的β多样性, 两样本点越接近, 表明两样本物种组成越相似。CK, 对照组; Cr_6d, Cr胁迫6 d ; Cr_6h, Cr胁迫6 h。Stress为反映模型合适程度的指标。
-
 图6
土壤理化因子与细菌(A)和真菌(B)群落的相关性分析。EC, 电导率; K, 钾含量, N, 氮含量; P, 磷含量。圆形点的大小表示相关系数的大小, 颜色表示相关系数的正负, 正方形色块表示相关性检验的p值。
图6
土壤理化因子与细菌(A)和真菌(B)群落的相关性分析。EC, 电导率; K, 钾含量, N, 氮含量; P, 磷含量。圆形点的大小表示相关系数的大小, 颜色表示相关系数的正负, 正方形色块表示相关性检验的p值。
-
 表3
铬(Cr)胁迫时间序列上土壤微生物群落的功能预测分析(平均值±标准差)
表3
铬(Cr)胁迫时间序列上土壤微生物群落的功能预测分析(平均值±标准差)
|
